
|

|
ATP-syntase from Bacillus PS3
Данная структура является первой полноценной структурой бацильной АТР-синатазы. Она была получена с помощтю метода криомикроскопии после экспрессии ATP-синтазы из Bacillus PS3 в Eschericia coli. Из бактерий фермент был выделен с помощью His-тага. Это мульти-субъединичный комплекс, который использует электрохимический градиент (протонный или натриевый) для синтеза ATP. В митохондриальной мембране фермент образует димеры, которые изгибают внутреннюю мембрану в кристы.
Фермент изучался в липосомах, на которых было показано, что протонный транспорт может обеспечиваться только разницей потенциалов или разницей концентраций натрия/протонов. Фермент состоит из двух комплектов: мембранного F0 и внемембранного F1. Комплекс F1 обеспечивает синтез/гидролиз АТР, а F0 – перенос протонов. Бактериальный белок по сравнению с митохондриальным устроен достаточно просто: его F1 комплекс составляют 3 α, 3 β, γ, δ и ε субъединицы, а F0 – 2 b, а и 10 с субъединиц.
В термофильной бацилле каталитическая субъединица ε ингибирует фермент, переводясь в up-конформацию тогда, когда в клетке понижается концентрация АТР. Высокая концентрация обуславливает конформацию down.
Стабильность белков термофильных бактерий зачастую обусловлена ионными взаимодействиями, более короткими петлями между элементами вторичной структуры и более плотной упаковкой гидрофобных ядер. Для АТР-азы термофилов по сравнению с мезофилами было показано только увеличение числа ионных взаимодействий. Можно предположить, что именно они вкупе с межсубъединичными взаимодействиями стабилизируют комплекс.[1]
На комплексе F1 расположены 3 каталитических сайта синтеза/гидролиза АТР, а так же 3 некаталитических сайта. Некаталитические сайты располодены на α субъединицах, а каталитические – между α и β субъединицами, причем большей своей частью лежат на β-субъединице. В некаталитических сайтах обнаруживается комплекс Mg-ATP. Фермент находится в конформации, для которой заингибирован гидролиз АТР.[2]
ε-субъединица у E.Coli имеет регуляторную α-спираль, которая разбита на 2 части петлей из 10 аминокислотных остатков. С помощью этой петли субъединица контактирует с субъединицей γ. Эта петля может стабилизировать up-конформацию субъединицы, что может объяснять причину, по которой ингибирование фермента из E. Coli не зависит от концентрации АТР.
Предположительно, субъединица эпсилон у Bacillus PS3 поддерживается в up-конформации. Предполагается, что она препятствует гидролизу АТР, но не его синтезу. Исходя из данных криомикроскопии, само столкновение между ε и γ-субъединицами блокирует ротор вращения при гидролизе.
Полуканалы, через которые переносятся протоны, схожи с митохондриальными и хлоропластными. Полуканал в цитоплазме формируется субъединицей а и с-кольцом, периплазматический – между α-цепями 1, 3, 4, 5 на субъединице а и промежутком между 5 и 6 α-спиралями с-кольца. Диаметр канала – 1.4 Å. Протон присоединяется на Glu56 на субъединице с, затем проворачивается в кольце в гидрофобной мембране, а затем передается на Arg169 субъединицы а. [1]
Фермент имеет множество ингибиторов; основными являются ADP, ε-субъединица и фосфат. Причем можно отметить, что у разных организмов регуляторный вклад каждого вещества может сильно отличаться. Фермент E. Coli в отличии от фермента Basillus PS3 может ингибироваться фосфатом, а сильное ингибиторное действие аденозиндифосфата на АТФ-азу наоборот отмечено на бациллах. Это может зависеть от образа жизни организмов: бациллы – свободноживущие аэробы, а кишечная палочка – факультативный анаэроб. [2]
Атлас контактов
Взаимодействия с низкомолекулярными лигандами
6N2Y
|
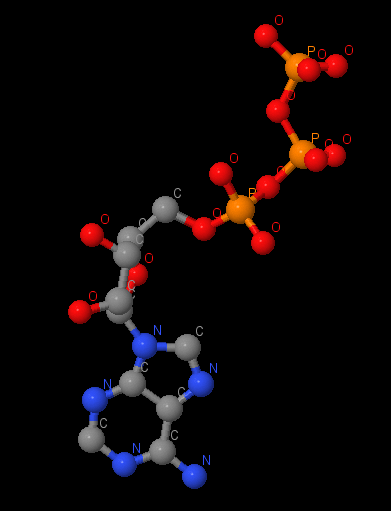
Название: аденозинтрифосфат (АТР) Брутто-формула: C₁₀H₁₆N₅O₁₃P₃ Название по UIPAC: [[(2R,3S,4R,5R)-5-(6-aminopurin-9-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl] phosphono hydrogen phosphate Молярная масса: 507,18 г/моль PubChem ID: 5957 |
|
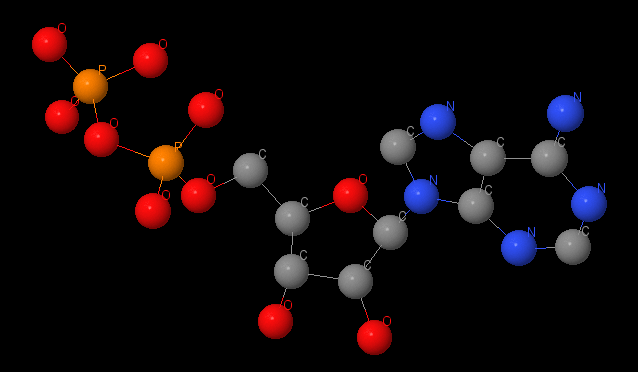
Название: аденозиндифосфат (АDР) Брутто-формула: C₁₀H₁₅N₅O₁₀P₂ Название по UIPAC: 9-{5-O-[Hydroxy(phosphonooxy)phosphoryl]-β-D-ribofuranosyl}-9H-purin-6-amin Adenosin5'-(trihydrogendiphosphat) Молярная масса: 427.203 г/моль PubChem ID: 6022 |
|

|
Название: магний Брутто-формула: Mg Название по UIPAC: Magnesium Молярная масса: 24,304 г/моль PubChem ID: 5462224 |
6N2Z
|
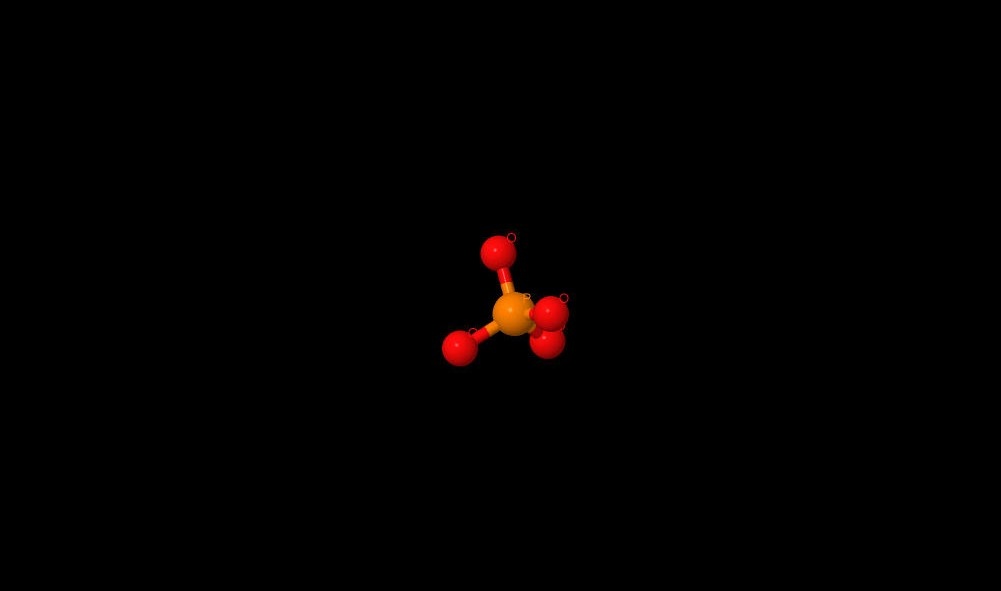
Название: фосфат ион Брутто-формула: PO4 3- Название по UIPAC: phosphate Молярная масса: 94.9714 г/моль PubChem ID: 1061 |
Описание белок-лигандных взаимодействий
6N2Y
.png)
|
Во всех трех некаталитических сайтах связан АТР, а каталитические сайты находятся в 3 конформациях: открытый (пустой), закрытый (пустой) и полузакрытый (с аденозиндифосфатом). |
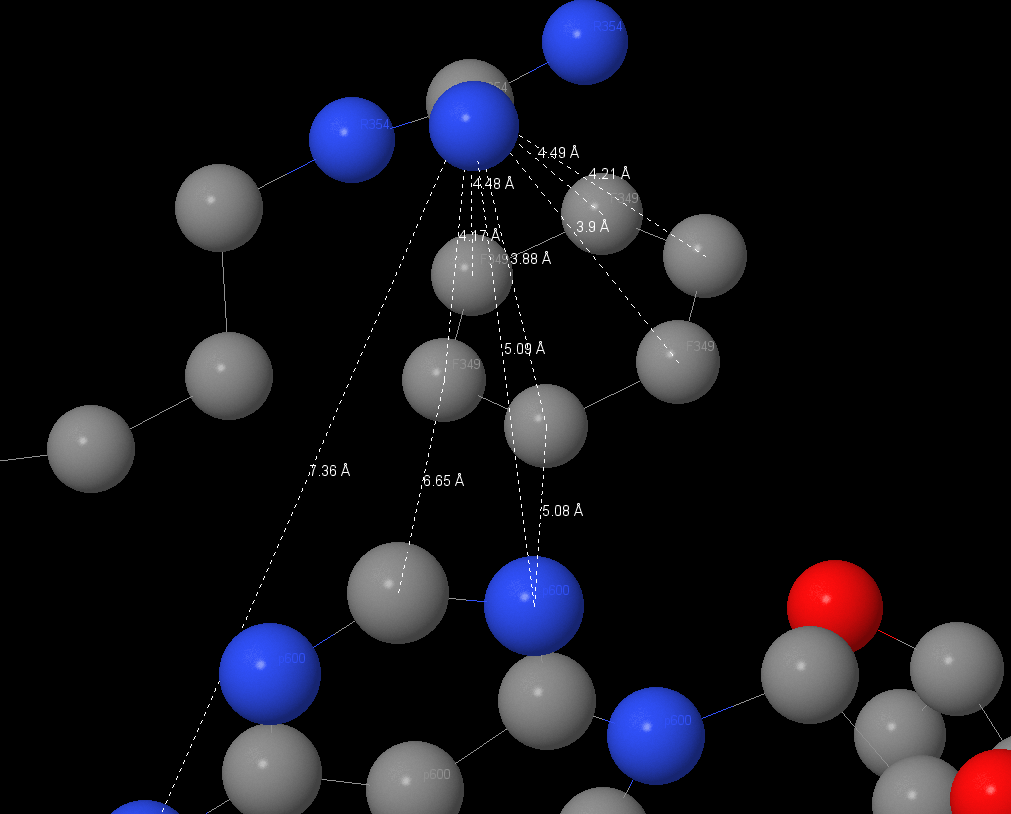
Один из атомов магния на α-субъединице имеет координационную связь с ATP, и, возможно, связан координационными связями через кислород или электростатическими взаимодействиями с 176Thr, 261Asp, АТР и через азот с остатком Glu200. Так же рассмотрим АТР, связанный в другой α-субъединице. Тут атом магния координационно пришит к Thr176 и молекуле АТР. Можно предположить существование водородных связей между молекулами кислорода в АТР и азотом Ser177, АТР и азотом Glu172 (подходящие длины между атомами). Для Gly174, Lys175 и Glu172 можно предполагать взаимодействие через солевые мостики. Длина отображений – 3 Å.
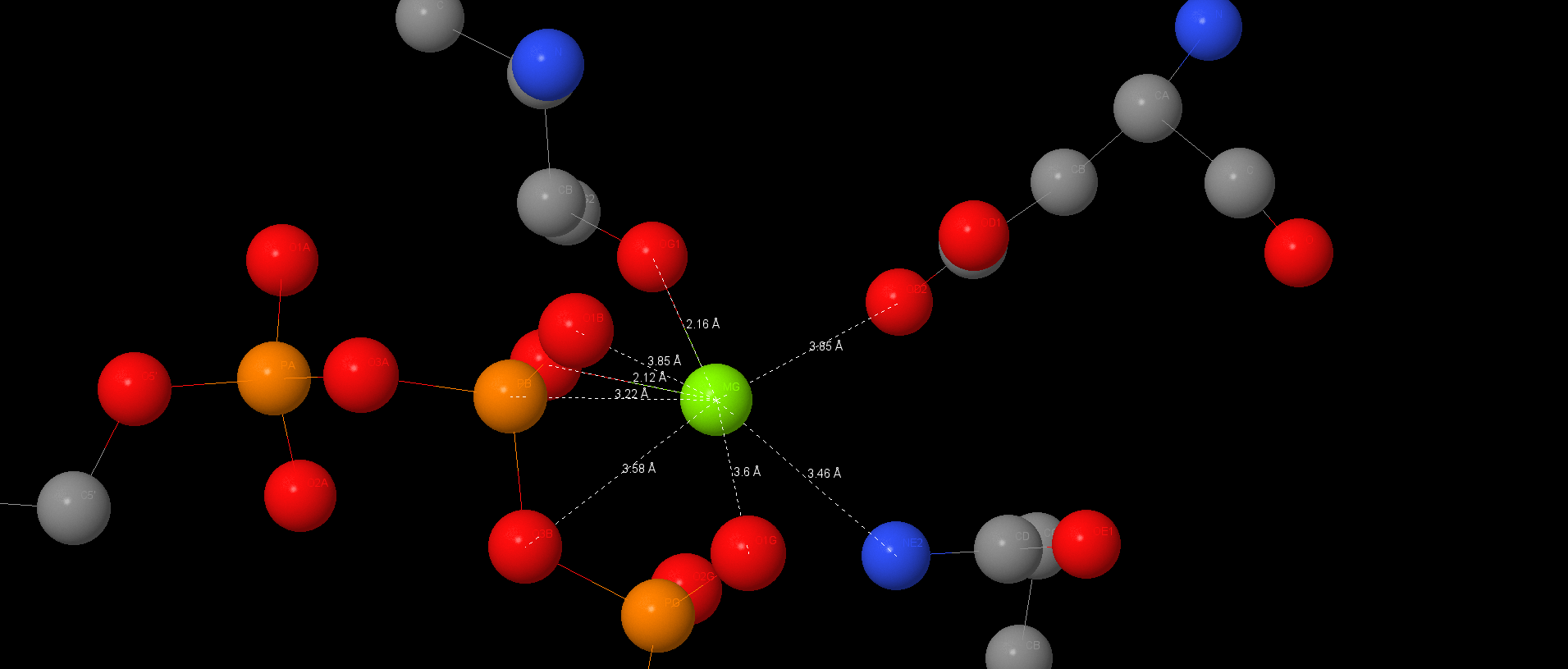
На расстоянии в 7 Å можно посмотреть на стекинг-взаимодействия между остатком аденина и ароматическим кольцом Phe349. Сопряженные pi-системы расположены боками друг к другу, что не так энергетически выгодно, как расположение друг над другом. Это взаимодействие может стабилизировать лиганд в некаталитическом сайте.
| Так же на расстоянии ~4.1 Å от кольца фенилаланина и ~5.1 Å от остатка аденина располагается концевая группа Arg354, которая взаимодействует с фенилаланиновым кольцом (pi-взаимодействие), и так же может стабилизировать АТР на некаталитическом сайте. |
|
Лигандом в полузакрытом каталитическом сайте является ADP – продукт гидролиза АТР. Он так же, как и АТР в некаталитическом сайте, стабилизируется стекинг-взаимодействиями с Tyr341 и Phe420. Здесь АТD также связан координационными связями с магнием, который координационно связан с белком.
Лиганды были предположены исходя из функций белка, а затем найдены с помощью Jmol. Также с помощью Jmol впоследствии были найдены атомы ближайшего окружения данных лигандов, измерены расстояния и предположены связи.
6N2Z
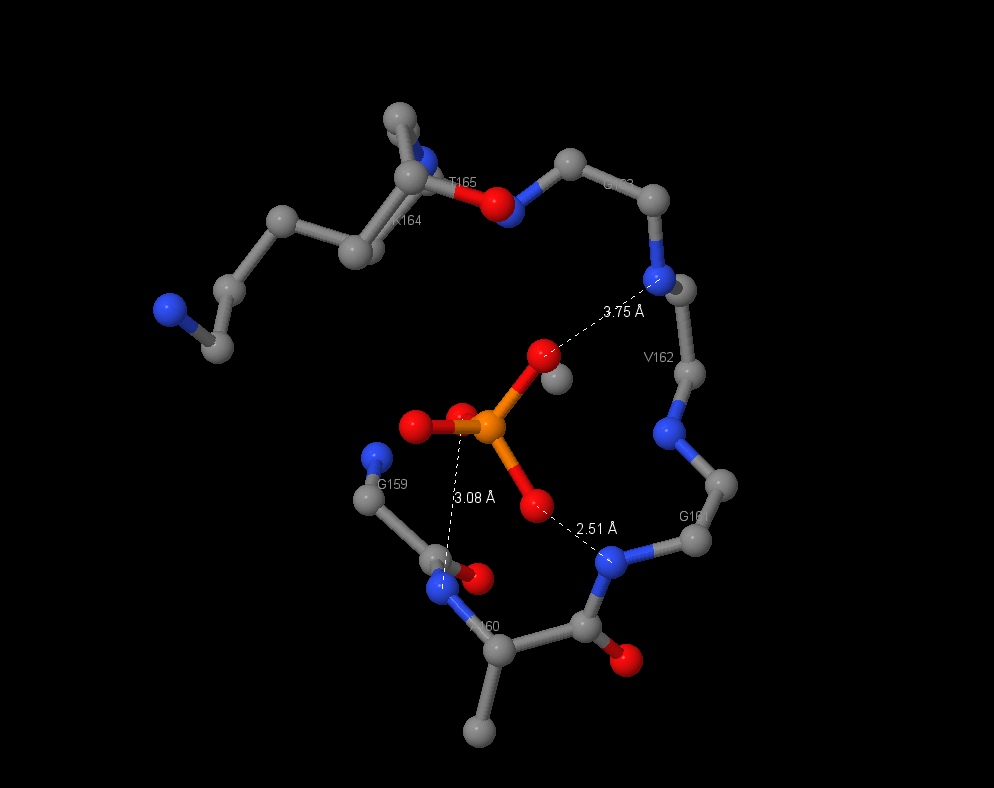
| Лиганд PO43- продукт гидролиза АТФ, расположен в β-субъединице, в полузакрытом сайти. У E.Coli может выполнять роль ингибитора. Вероятно, соединен водородными связями с окружающими его аминокислотами. Длина связи с Gly161 - 2,51 Å, а с Ala160 - 3,08 Å. |
|
Внутрибелковые взаимодействия
6N2Y
Стекинг-взаимодействия
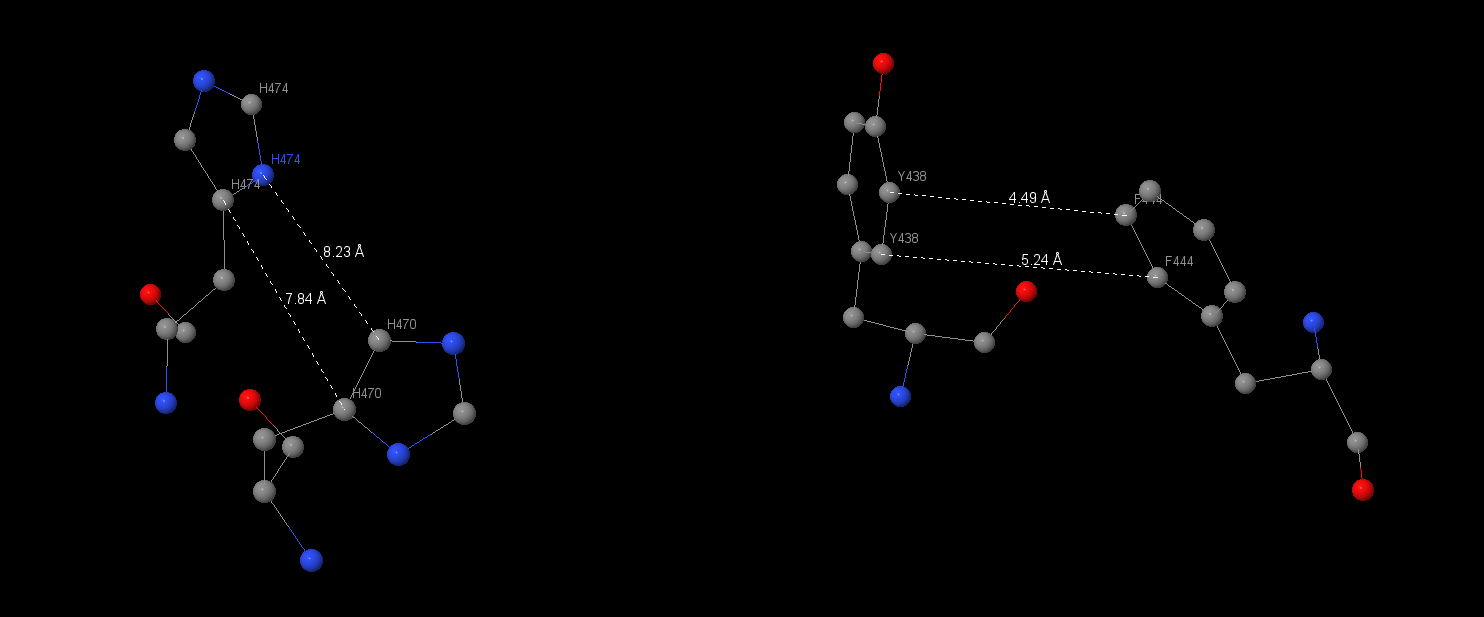
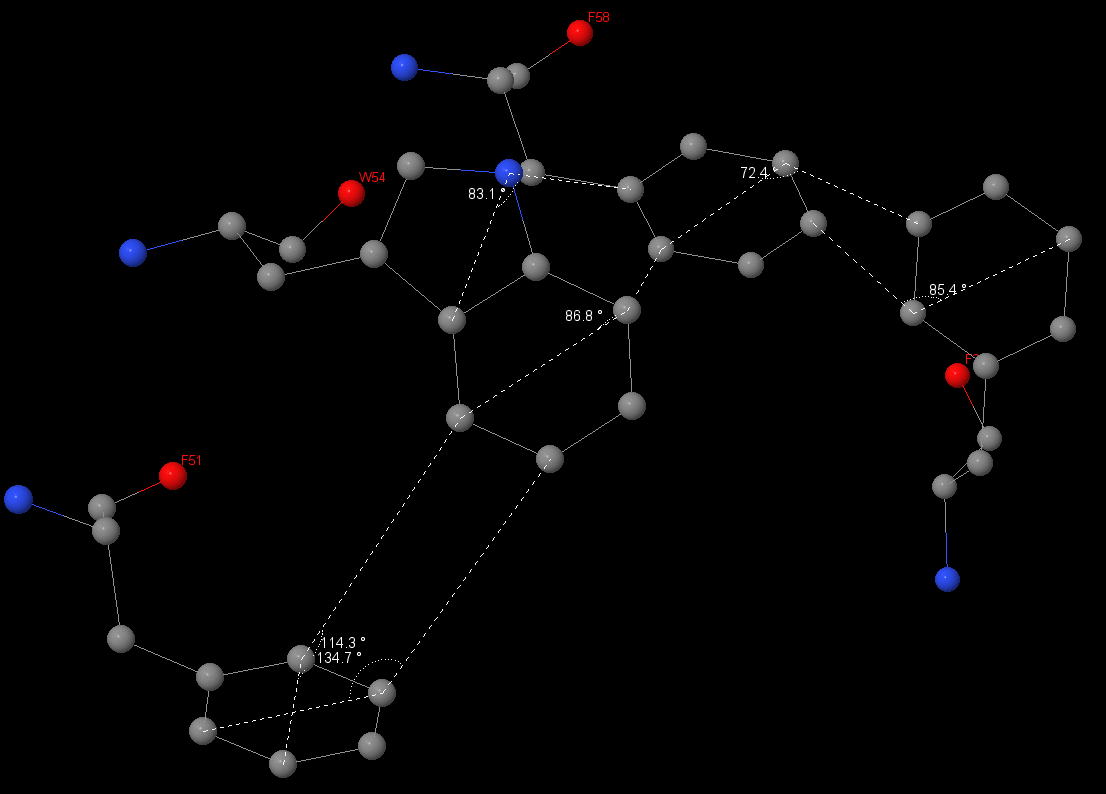
Стекинг-взаимодействия очень распространены в АТР-азе в формате связей между 2-3 ароматическими кольцами. Найдены стекинг-взаимодействия на α-субъединице между Hys470 и Hys474 и между Tyr438 и Phe444.
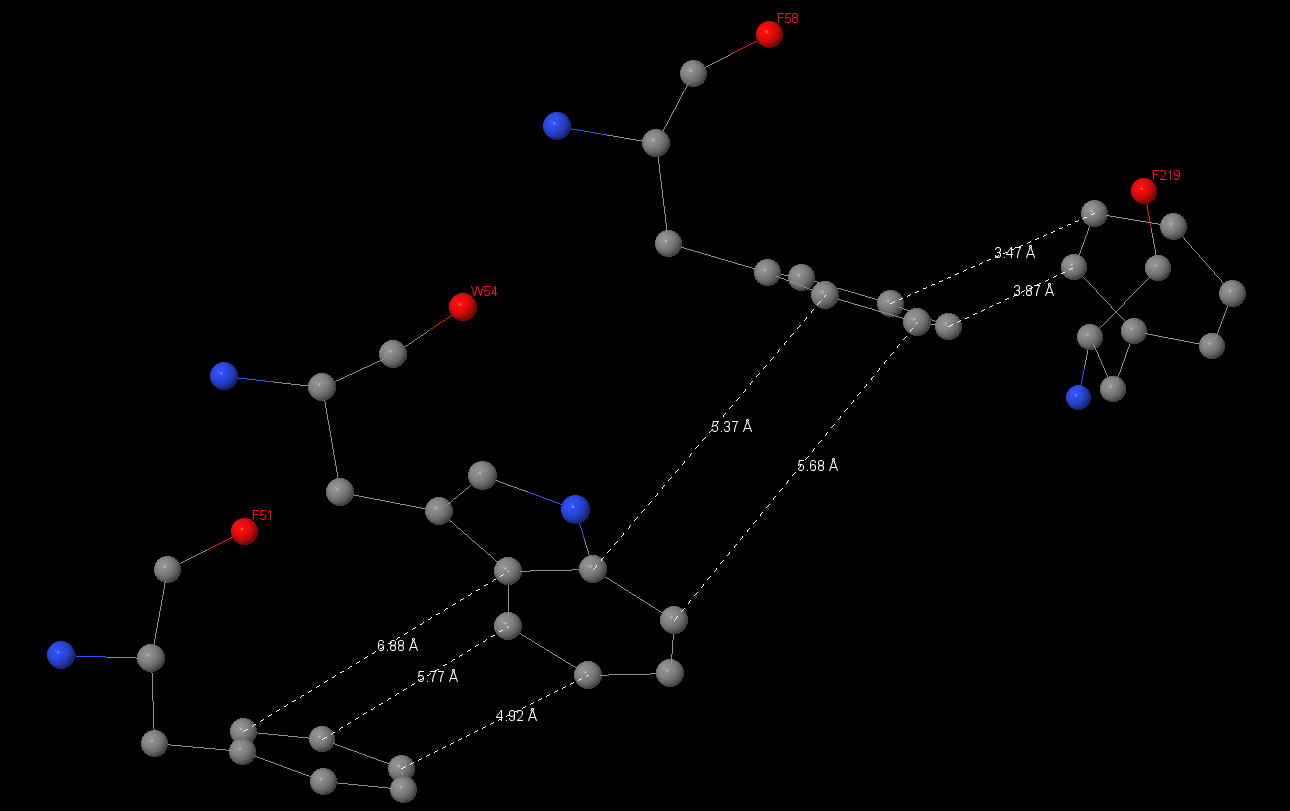
| Были посчитаны длины между атомами ароматических колец. Для первого взаимодействия они составили — 7.84 и 8.32 Å, на втором – 4.49 и 5.24 Å. Более масштабное стекинг-взаимодействие было найдено в субъединице α между Phe51, Trp54, Phe58 и Phe219. Так же были измерены длины связей в этой системе: 51 и 54 аминокислоты: 6.88, 5.77, 4.92 Å; 54 и 58: 5.37, 5,68 Å; 58 и 219: 3.47, 3.87 Å. |
|
| Уголы между плоскостями колец стремятся к 90 градусам (так как кольца расположены почти что друг над другом). Также были измерены углы между плоскостями колец аминокислот: между 51 и 54: 134.7, 114.3 °; между 54 и 58: 83.1, 86,8 °; между 58 и 219: 72,4, 85.4 °. | |
|
|
Стекинг-взаимодействие было найдено с помощью выделения всех остатков, содержащих сопряженные pi-системы. Затем были выбраны те из них, которые расположены рядом и приблизительно друг над другом. Также особое внимание было уделено более протяженным системам.
Гидрофобное ядро
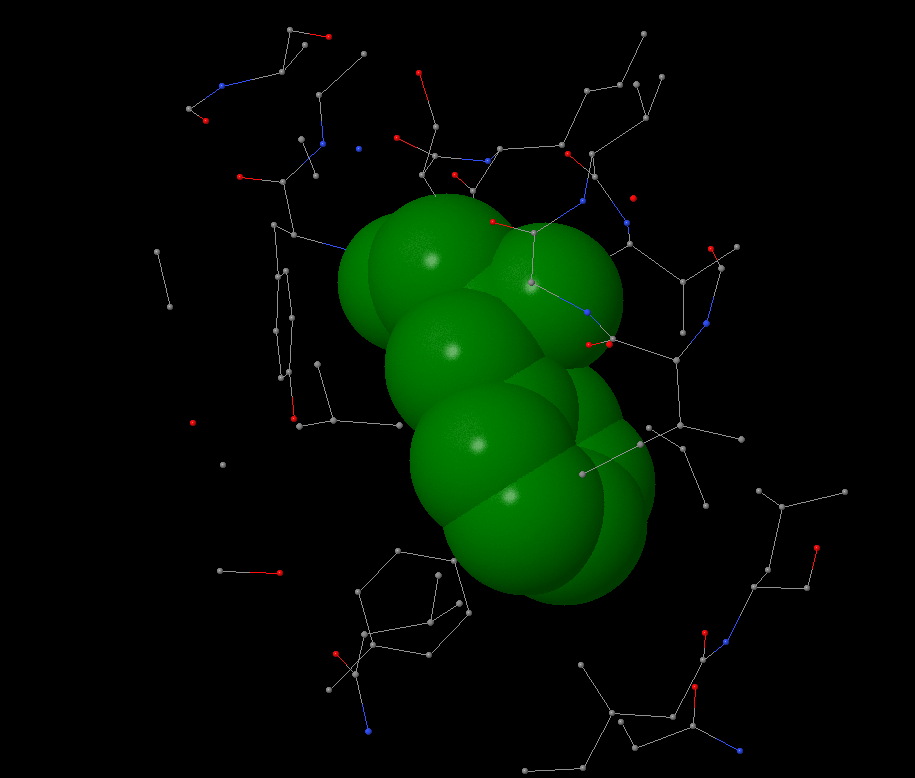
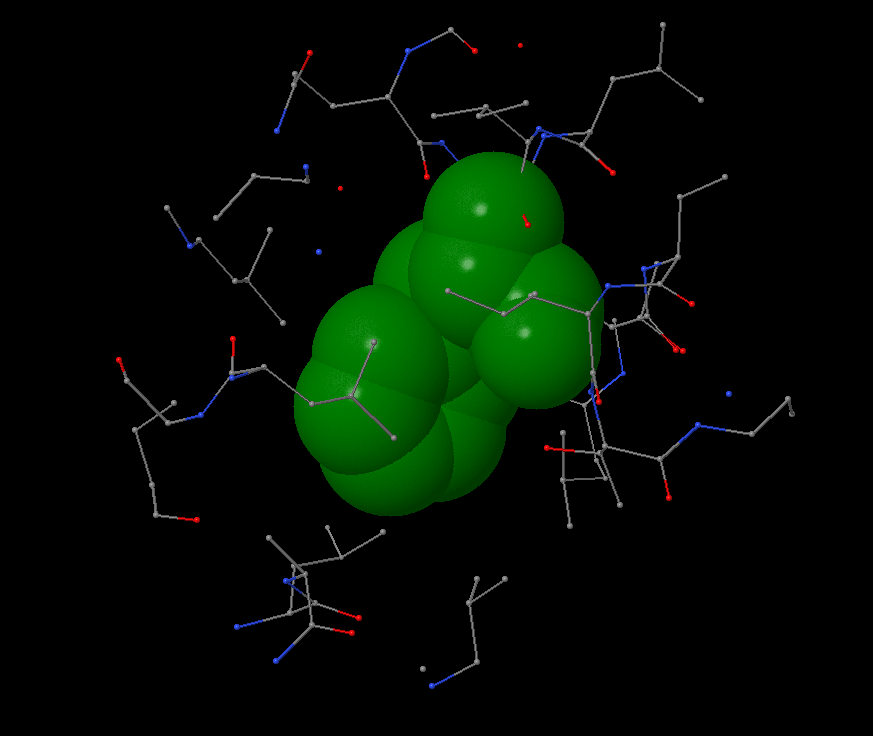
Рассмотрю гидрофобное ядро у Phe65 на субъединице из с-кольца. Остаток фенилаланина окружен в основном остатками изолейцина и лейцина из своей и соседней белковой цепи с-кольца.
Первые атомы около ароматического остатка фенилаланина появляются на расстоянии 4 Å, а остаток почти полностью окружается другими атомами на расстоянии 6 Å. В этот гидрофобный карман не сможет поместиться ни один атом: средний радиус атома – 1.7 Å, поэтому расстояние между ван-дер-ваальсовыми радиусами приблизительно равно 0.5-1.5 Å, что не позволяет поместиться в этот карман ни единому атому.
|
Можно также отметить, что в с-кольце расположено множество гидрофобных остатков и, соответственно, гидрофобных ядер, так как этот субъединичный комплекс погружен в мембрану. Среднее расстояние между атомами белка, не сшитыми ковалентно, приблизительно равно 4.5-5 Å. |
Для поиска взаимодействий я нашла большую гидрофобную аминокислоту, такую как фенилаланин, выбрала самый красивый и начала работать с помощью команды "within".
Структурные водородные связи
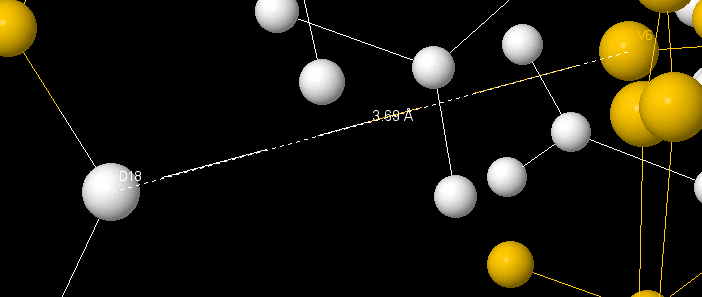
На ε субъединице можно посмотреть на водородные связи, которые связывают между собой различные вторичные структуры белка. Например, связь между Val6 и Asp18 с длиной в 3.69 Å(возможно, является солевым мостиком) связывает β-слой и петли вторичной структуры (желтый – β-слои).
|
|
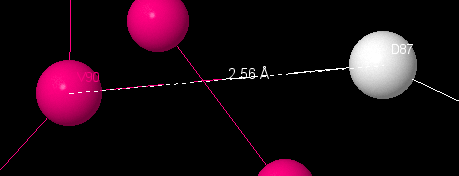
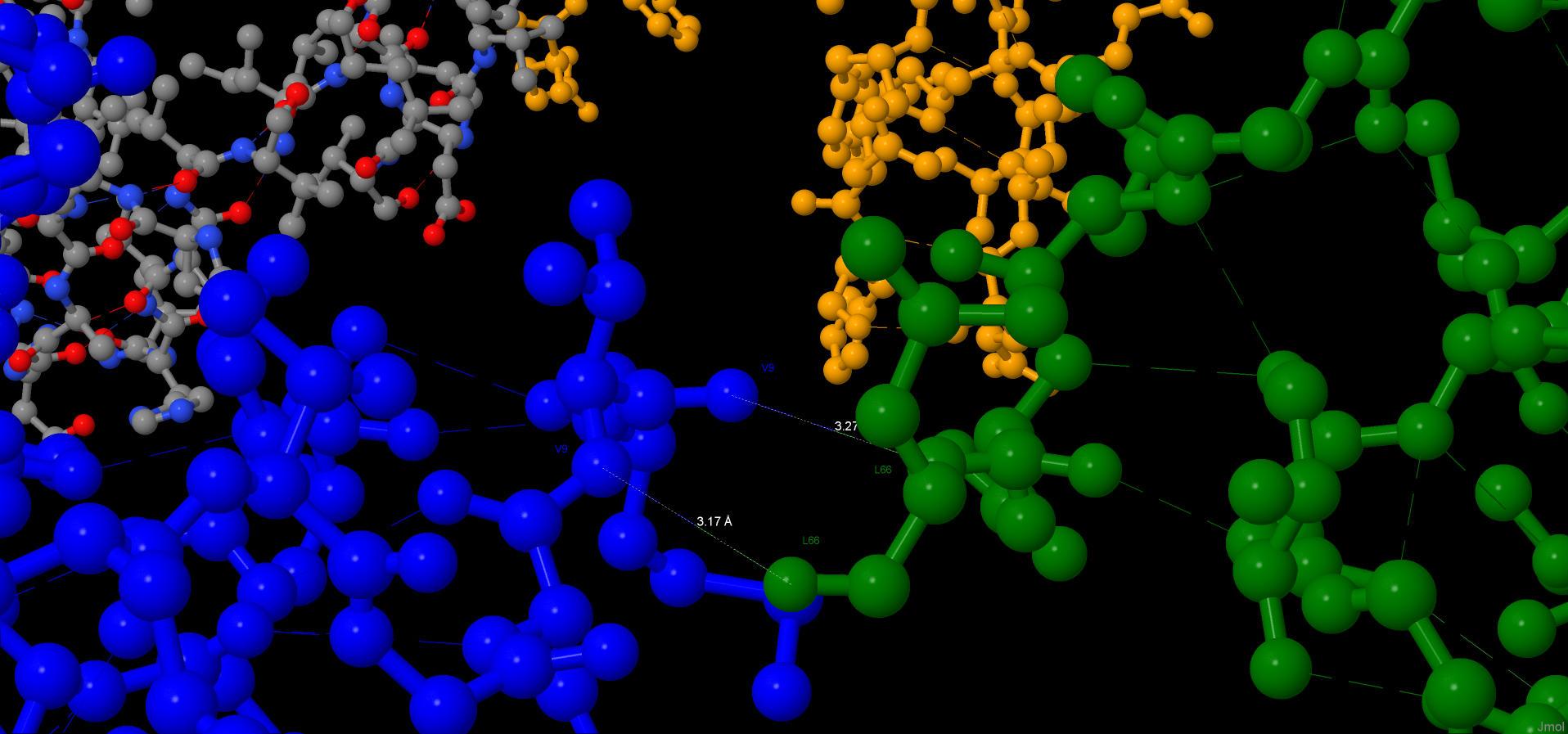
Между Val90 и Asp87 так же есть водородная связь, которая связывает между собой α-спираль и петли вторичной структуры. Ее длина – 2.56 Å. Между Ala79 и Ile77 и между Ala79 и Val9 также существуют трансструктурные водородные связи с длинами в 3.17 и 3.48 Å.
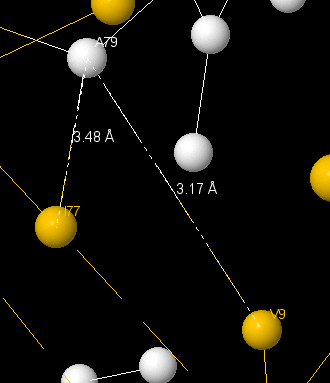
Все связи найдены в ε-субъединице, которая является регуляторной и структурной. На данных изображениях в желтый цвет покрашены атомы из β-листов, в розовый – α-спирали, а в белый – петли между элементами вторичной структуры.
Взаимодействия были найдены с помощью просматривания субъединиц белка, покрашенных по элементам вторичной структуры, с посчитанными с помощью Jmol водородными связями. Связи были отпределены визуально: связи между разными элементами вторичной структуры двухцветные.
Водородные связи на элементе вторичной структуры
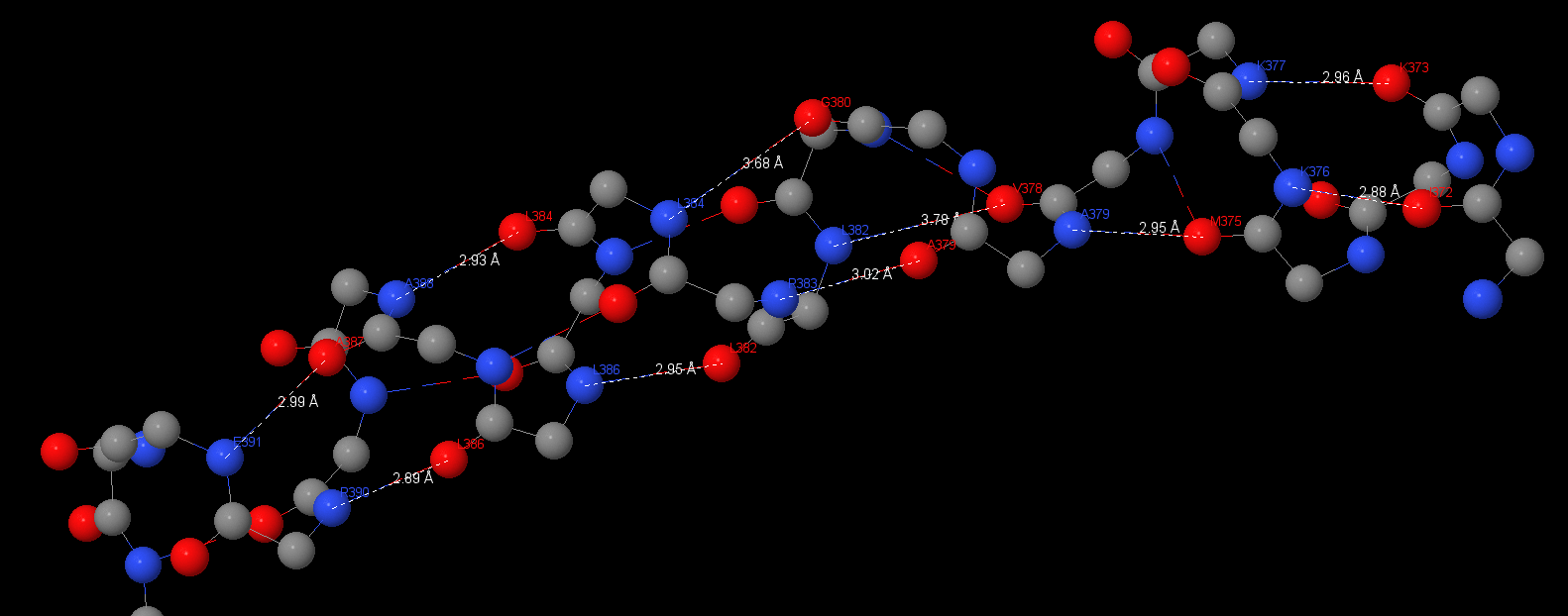
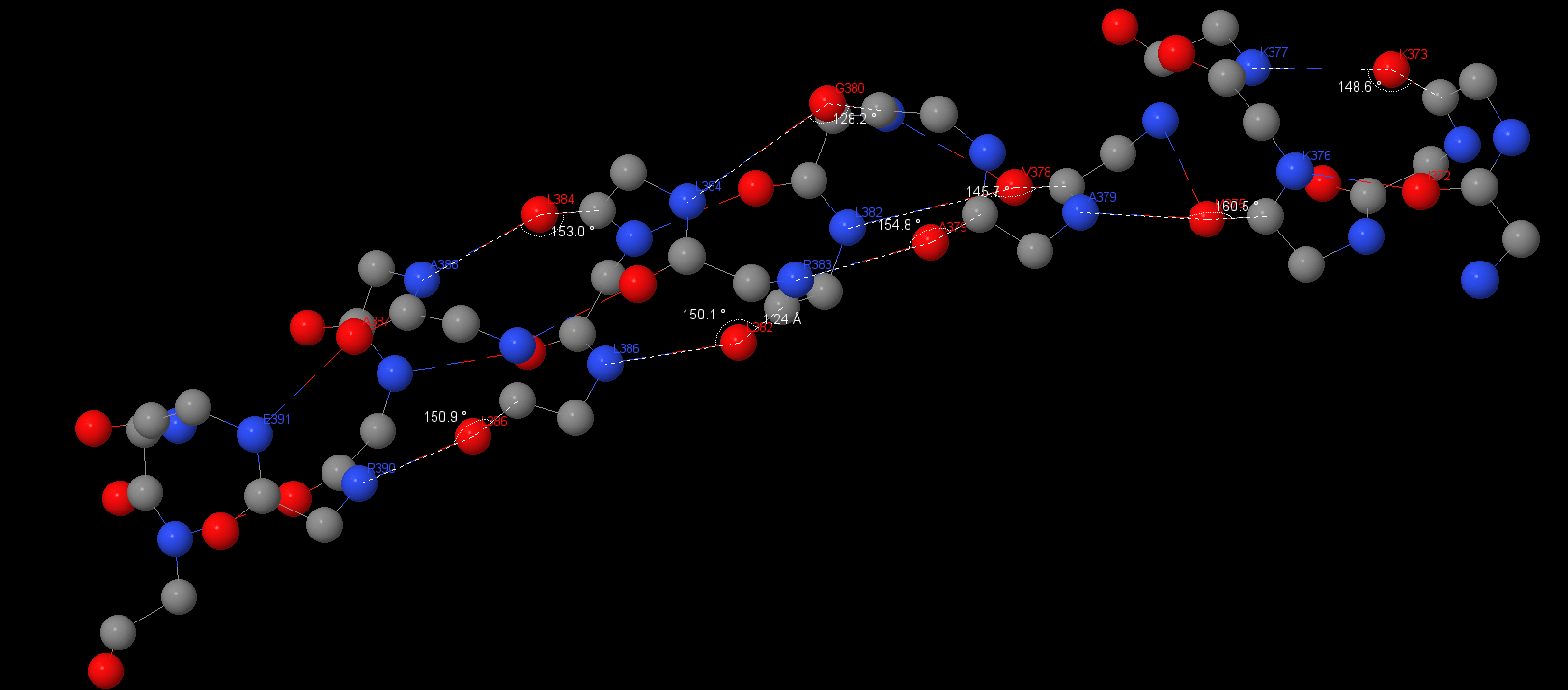
В данном комплексе находится множество элементов вторичной структуры: 3.10 α-спирали и β-листы. Водородные связи показывают типичные значения длины и углов:
391Glu(N) – Ala387: 2.99 Å;
Asp390(N) – Lys386: 2.89 Å, 150.9°;
Ala388(N) – Lys384: 2.93 Å, 153°;
Lys386(N) – Lys382: 2.95 Å, 150.1°;
Asp383(N) – Ala379: 3.02 Å, 154.8°;
Ala379(N) – Met375: 2.95 Å, 160.5°;
Asp376(N) – Ile372: 2.88 Å;
Asp377(N) – Asp373: 2.96 Å, 148.6°;
Среднее значение по длинам водородный связей — 2,95 Å; а по углу водородной связи — 153°. Длины водородных связей стремятся к идеальным 3 Å, а угол отклоняется от идеального в пределах 30°. Поиск данного типа контактов был наиболее простым, так как в данном комплексе встречается множество элементов вторичной структуры. Также можно отметить очень длинные α-спирали на b-субъединицах и на субъединице ε.
S-S мостики
S-S мостики в белке не были найдены, так как в белке есть всего-навсего один грустный цистеин.
Солевые мостики
Солевые мостики были найдены на β-субъединице комплекса F1. Я рассмотрела взаимодействие между тремя аминокислотами: глутаминовыми кислотами и лизином.
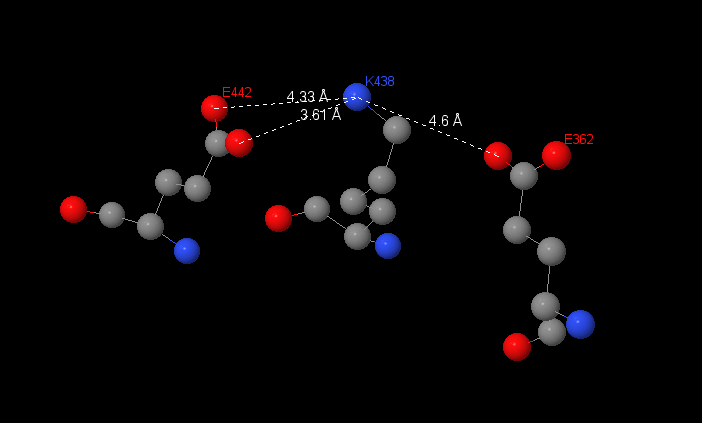
|
Солевые мостики не имеют таких четких ограничений по расстояниям и углам, как водородные связи, поэтому их можно предположить между боковыми радикалами Glu442 и Glu362 и остатком Lys438. |
Длины этих связей — 3.61, 4.33 и 4.6 Å. Но по закону Кулона, электростатическое взаимодействие тем выгодней, чем ближе расположены между собой заряженные частицы, поэтому я предполагаю солевой мостик именно между Glu442 и Lys436, так как это расстояние самое короткое.
Солевые мостики я искала с помощью выделения аминокислот, чьи боковые радикалы заряжены при внутриклеточном pH. Затем были выбраны близкорасположенные остатки, посчитаны расстояния между ними.
6N2Z
Структурные водородные связи
β-листы в АТФ-синтазе могут быть связаны водородными связями (хотя они и очень редки). Средняя длина связи N-O составляет в них 3,13 Å, а средний угол N-O-C - 123°. Таким образом, длина связи хорошо укладывается в теоретические значения, а угол несколько меньше теоретически ожидаемого.
Гидрофобный карман
|
При удалении на расстояние в 4-5 Å от фенилаланина атомы аминокислотных остатков, начинают "закрывать" его. Характерное расстояние между соседними не связанными ковалентно атомами в белке составляет 4,52 Å (измерения: 4,36, 4,68, 5,5). |
Jmol-апплет, отображающий показанные взаимодействия
|
|
Скачать скрипты
Источники
1. Hui Guo, Toshiharu Suzuki, John L Rubinstein. «Structure of a bacterial ATP synthase», eLIFE 2019
2. Лапашина А.С., Фенюк Б.А. «АДФ-ингибирование H+-F0F1-АТФ синтазы», Биохимия 2018
Вклад авторов
Зубарева Валерия искала взаимодействия в структуре 6N2Y, описывала их, писала Jmol-скрипты. Также она описывала сам белок, занималась написанием html-страницы и переводила сайт на английский язык.
Шиляева Мария занималась описаниями связей в структуре 6N2Z, описывала их и писала Jmol-скрипты.
Причины выбора 2 структур
В статье eLIFE, 2019 были представлены 3 полученные структуры АТР-азы, которые отличаются друг от друга состоянием каталитических сайтов. Так как в группу были объединены люди с абсолютно разным графиком работы и работоспособностью, к выходным 2-3 марта Зубарева Валерия описала все типы взаимодействий в структуре 6N2Y. Поэтому был предложен несколько другой вариант выполнения работы и была взята другая структура белка, в которой был найден новый лиганд — ион фосфата.
Третий участник группы, причины отдельного абзаца
Групповую работу координировала Зубарева Валерия, она просила всех остальных участников группы сделать материал к вечеру воскресенья, чтобы осталось достаточно времени на верстку сайта, перевод на английский и исправление ошибок. Но третий участник группы работу не сдал, не предупредил о сроках сдачи, поэтому мы закончили без нее. Но так как работа все же была сделана, пусть и не в срок, мы не можем бросить человека. Но я считаю правильным оформить его часть на отдельной странице. Спасибо за понимание.