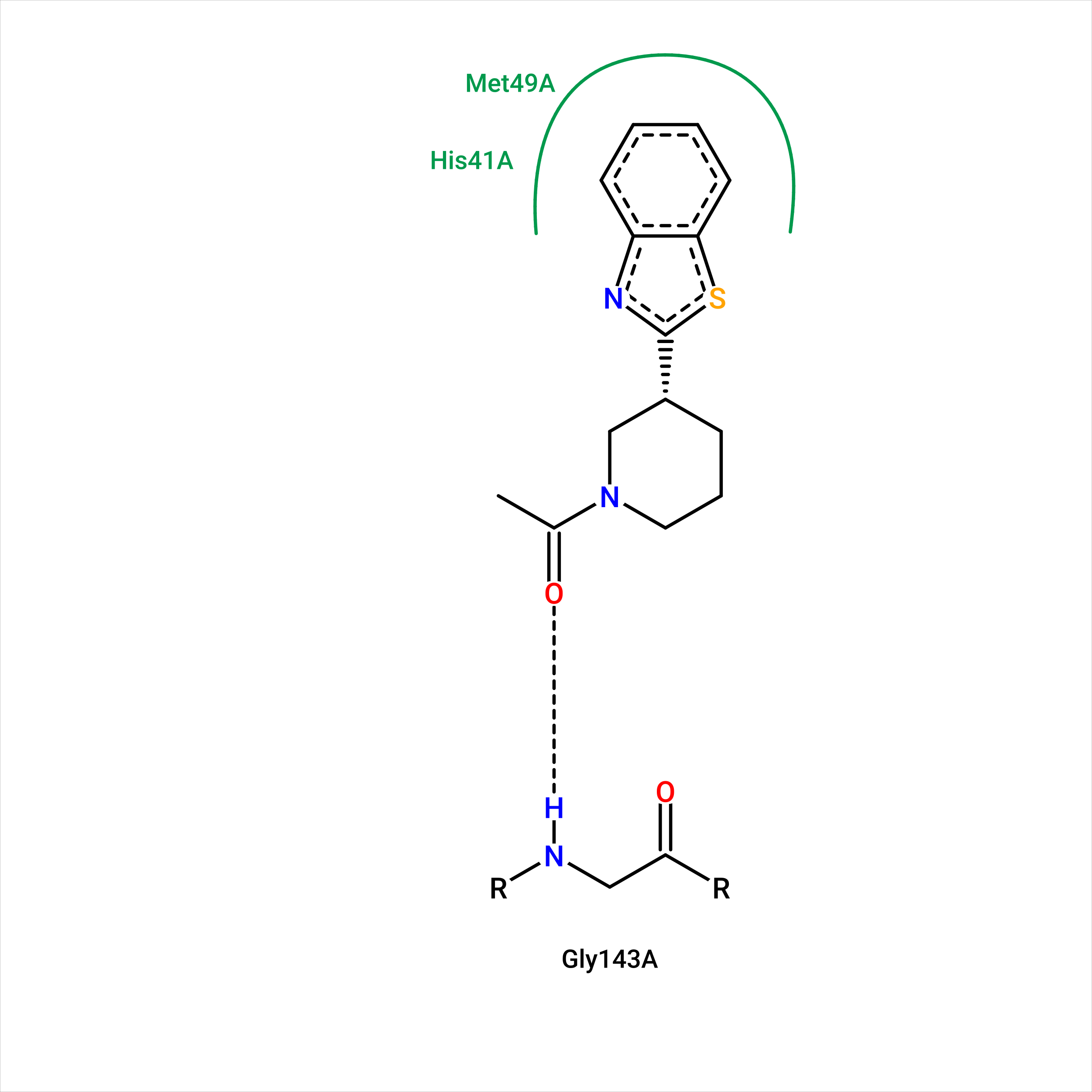
Рисунок 1.1 Изображение связей лиганда в 5REN с помощью PoseView.
PDBID:5REN
В данном задании сравнивним связи лиганда с белком в стуктуре 5REN, установленные в первом практикуме, с связями, которые обнаруживает PoseView.

Рисунок 1.1 Изображение связей лиганда в 5REN с помощью PoseView.
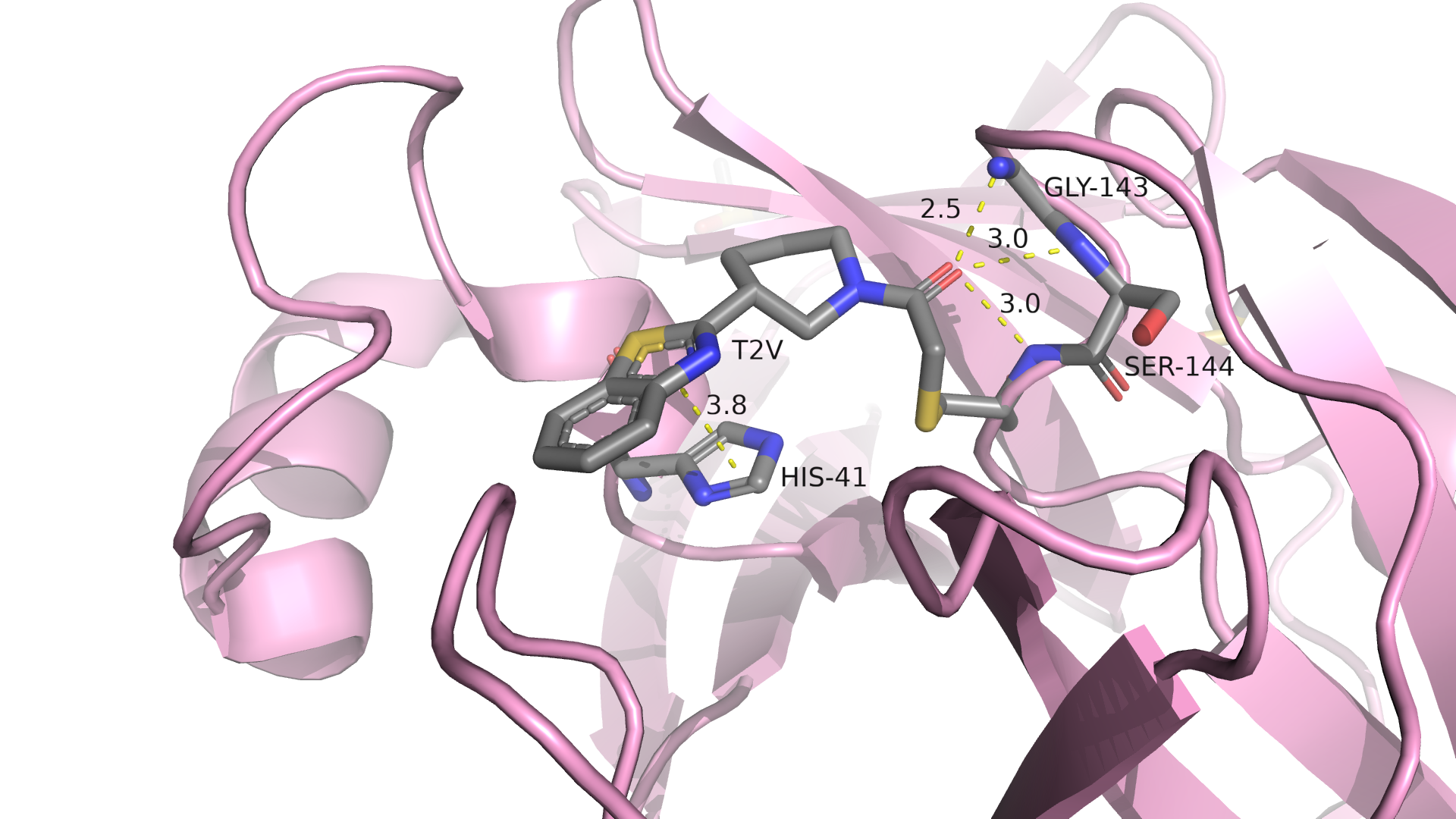
Рисунок 1.2 Связи лиганда в 5REN, обнаруженные в первом практикуме.
Примечательно, что PoseView отобразил только одну водородную связь из тех, что были предположены в первом практикуме, но, как мне кажется, наиболее правдоподобную из всех. Было обнаружено стекинг-взаимодействие с HIS-41 и взаимодействие с MET-49, которое я не приводил в первом практикуме. Отсутствующие в выдаче PoseView водородные связи не выглядят очень качественными, возможно, в первом практикуме их и не стоило отображать.
PDBID:0033, 0066
В данном задании необходимо было угадать, какой аминокислотный остаток находился под номером 5 в цепи C в структуре 0033 и под номером 485 в цепи Q в структуре 0066.
Рассмотрим окружение остатка в структуре 0033.
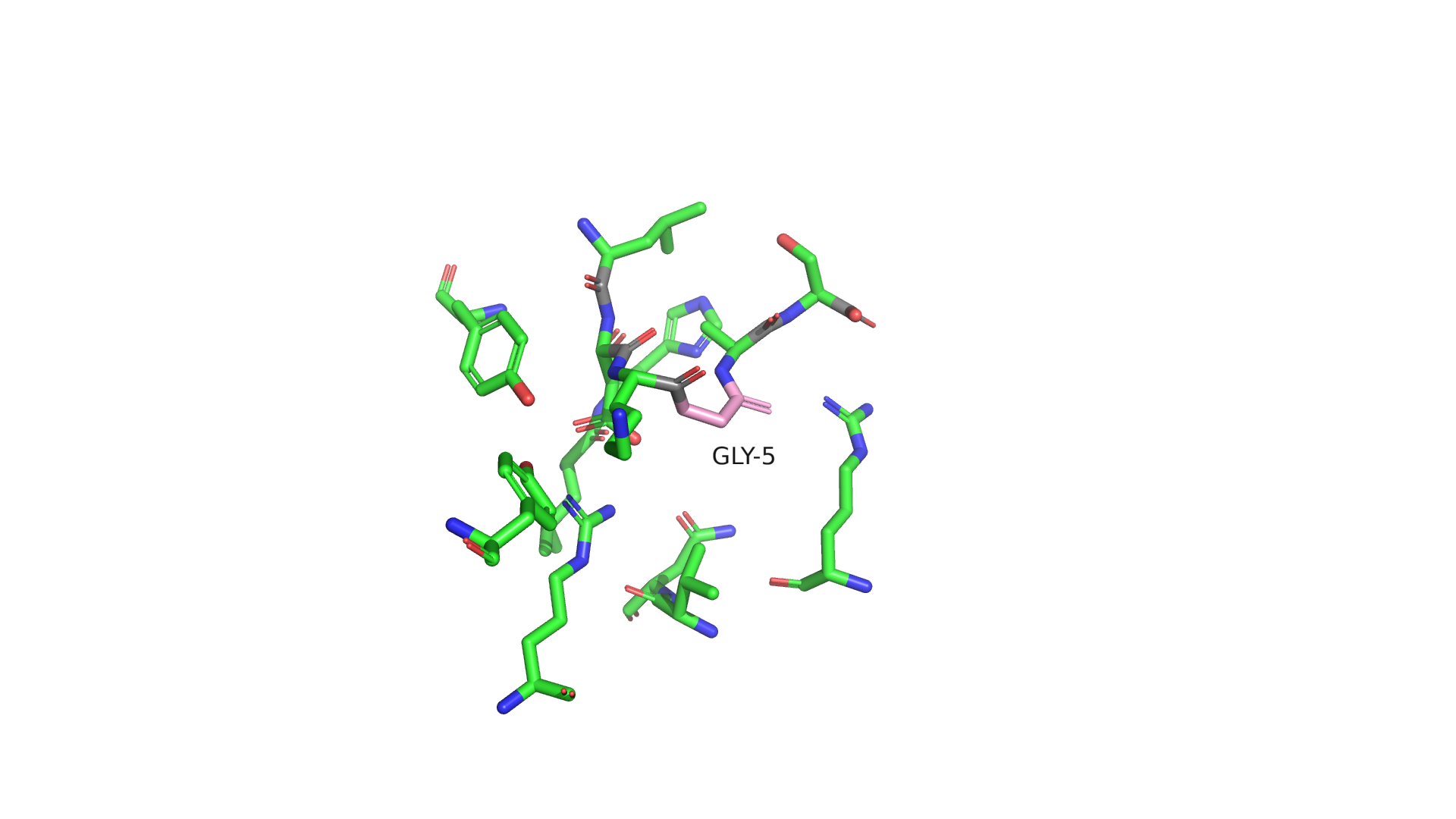
Рисунок 2.1 Окружение 5-го остатка цепи C в структуре 0033(розовый). Углероды остова полипептида окрашены в серый.
Цепь C представляет короткий полипептид. Попробуем подобрать замену на основании формы, показателей strain и представленности ротамера. Как мне кажется, под номером 3 мог находиться триптофан. Он достаточно хорошо подходит по форме, имеет относительно невысокий strain(24.89) и является первым по встречаемости среди ротамеров. Кроме того, при такой замене возможно образование водородной связи с GLY-33.

Рисунок 2.1 Замена 5-го остатка на триптофан.
Теперь рассмотрим структуру 0066. В данной структуре нам необходимо догадаться, какой остаток был под номером 485 в цепи Q. Рассмотрим окружение остатка. Становится понятно, что рядом с остатком достаточно длинная полость, можно предположить, что на этом месте может быть какой-то протяженный радикал.
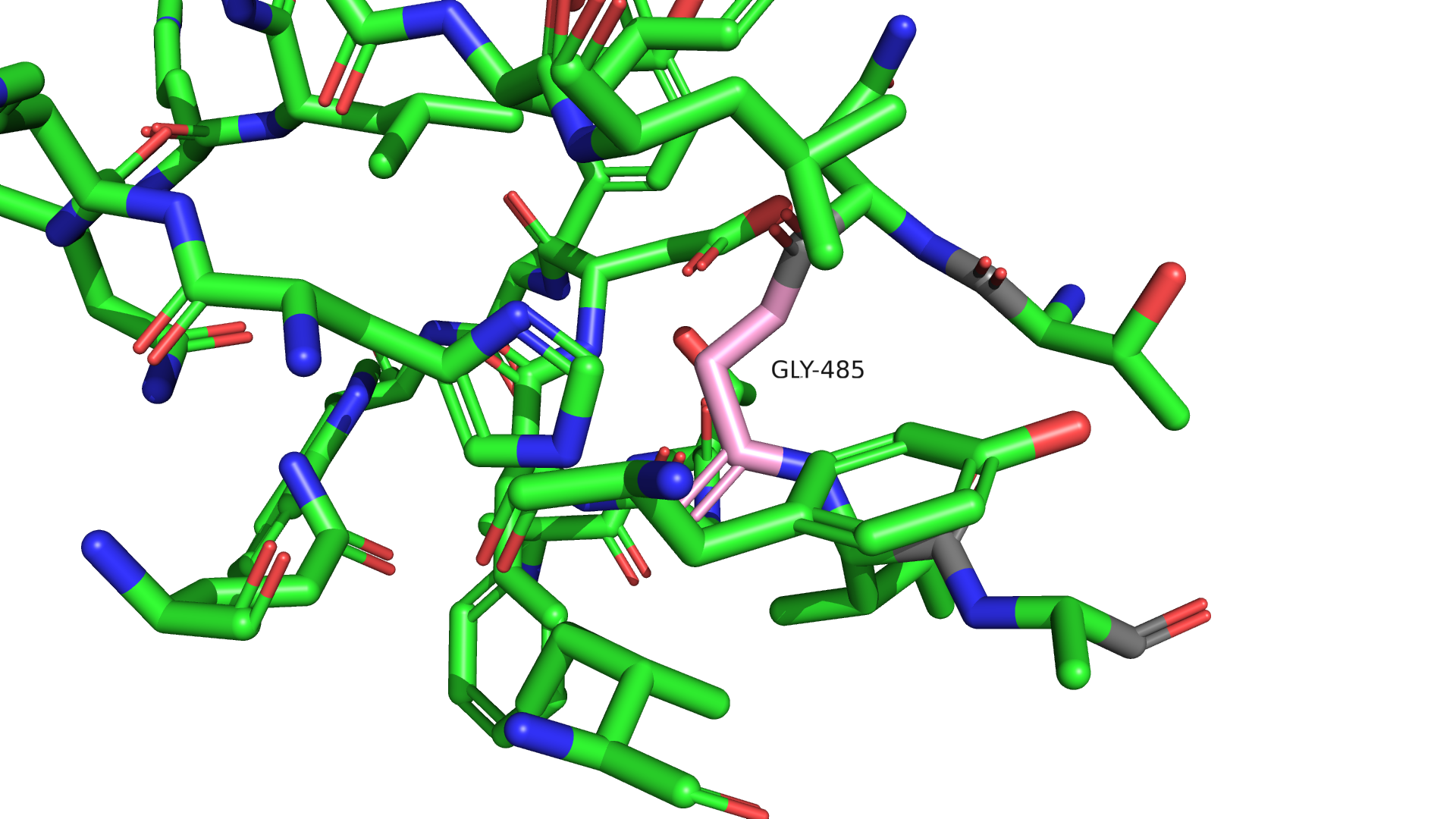
Рисунок 3.1 Окружение 485-го остатка цепи Q в структуре 0066(розовый). Углероды полипептида окрашены в серый.
Первое, что приходит на ум, это Lys. Попробуем заменить остаток на него.
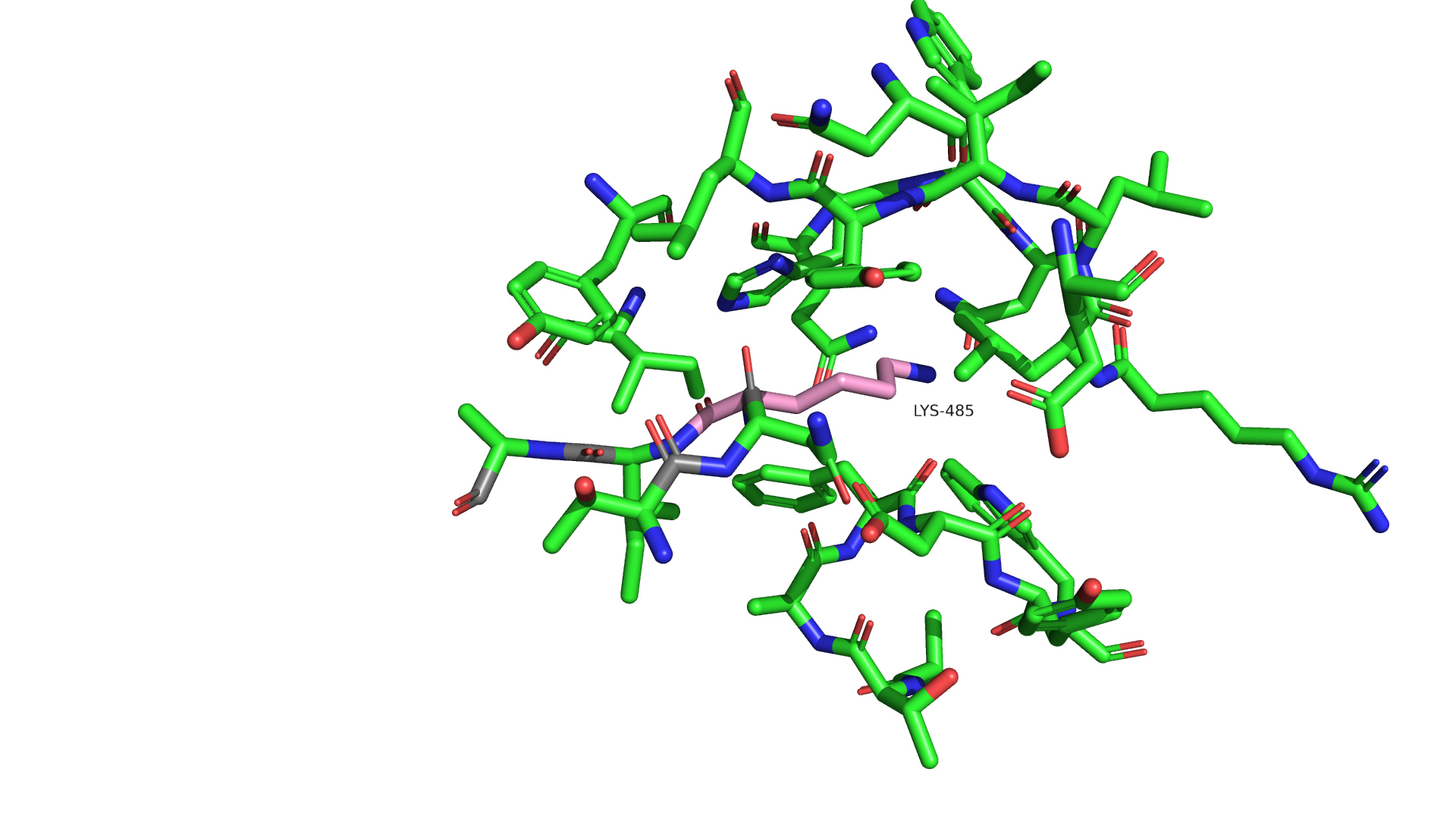
Рисунок 2.1 Замена 485-го остатка на лизин.
По форме подошел относительно неплохо, однако для взаимодействия полипептида с белком хотелось бы видеть больше связей. Попробуем заменить на гистидин.
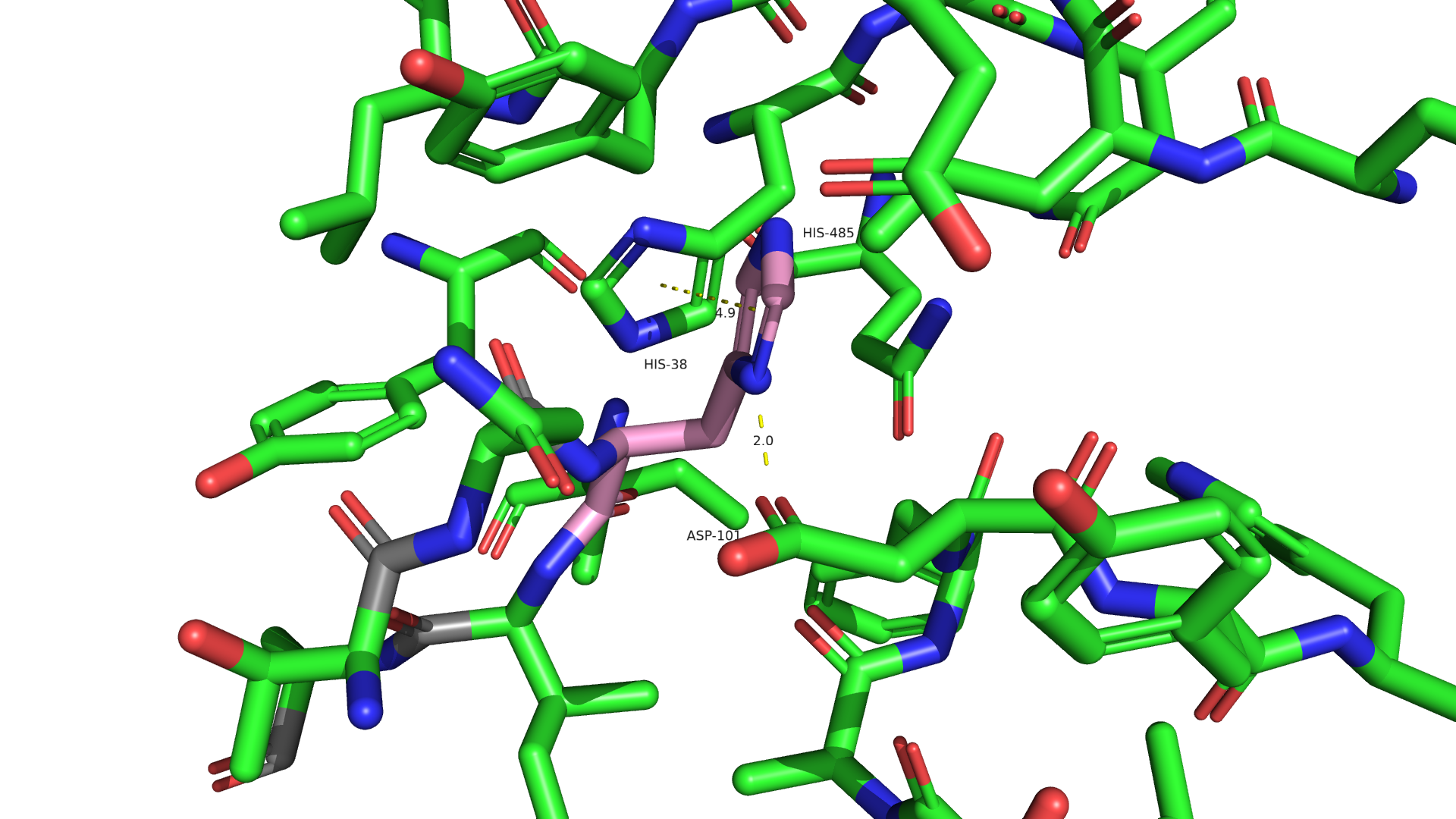
Рисунок 2.2 Замена 485-го остатка на гистидин.
Как мне кажется, именно гистидин был на месте 485-го остатка. Он, как мне кажется, может образовывать водородную связь с ASP-101 и стэкинг с HIS-38. Стоит отметить, что некоторые сомнения вызывает достаточно высокий strain(39), однако он идет вторым по встречаемости среди ротамеров.
© Simon Konnov 2017-2020