Перед началом работы было проверено, что выбранная структура (PDB ID: 2AQ9) удовлетворяет следующим требованиям:
1) Со страницы структуры доступен для скачивания файл с электронной плотностью и файл с экспериментальными данными РСА;
2) Имеются подходящие структуры белков, сходных одним из белков вашей модели: в таблице с находками более 5 (10) разных белков с 0.8 Å ≤ RMSD ≤ 3.0 Å и 259 ≤ Nalgn ≤ 269 (от 50% до 90% числа а.о. 2AQ9);
3) В доступе имеется статья, опубликованная по результатам расшифровки.
Для скачивания также доступен отчет о качестве расшифровки структуры.
Рассмотренный нами белок УДФ-N-ацетилглюкозамин ацилтрансфераза (далее – lpxA) представляет собой важный объект для изучения. LpxA является катализатором первой стадии пути биосинтеза липида А – эндотоксина, заякоривающего липополисахаридный слой в наружной мембране грамотрицательных бактерий.
Наличие данного белка является необходимым условием для поддержания жизнедеятельности бактериальной клетки. Кроме того, известно, что белки, принимающие участие в биосинтезе липида А, уникальны для бактерий, что позволяет минимизировать проявления побочных эффектов у эукариот при проведении антибактериальной терапии.
Вышеперечисленное позволяет рассмотреть белок lpxA в качестве потенциальной мишени для антибиотиков. Кристаллическая структура комплекса белка lpxA с пептидом 920, выбранная нами для анализа, получена с целью открыть новые подходы к дизайну и синтезу ингибиторов lpxA – эффективных антибактериальных препаратов.
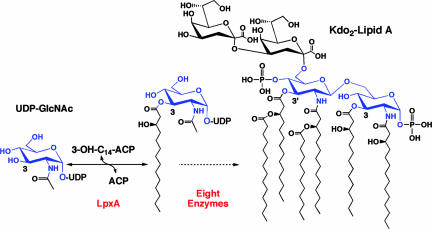
Рисунок 1. Функция LpxA в процессе биосинтеза липида А. Белок переносит R-3гидроксиацильную часть с R-3-гидроксиацил - АЦП на УДФ-N-Ацетилглюкозамин
Белок LpxA – гомотример. Структуру отличает наличие 24 полных и шести частичных повторов гексапептидов. Три непрерывных повторения гексапептидов (18 аминокислотных остатков) складываются в одну катушку левозакрученной βспирали.
Такая укладка является характерной для многих бактериальных ацил- и ацетилтрансфераз.
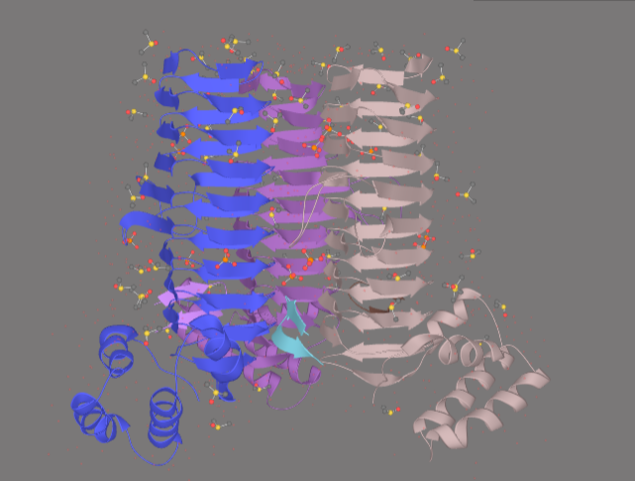
Рисунок 2. Структура комплекса lpxA с пептидом 920
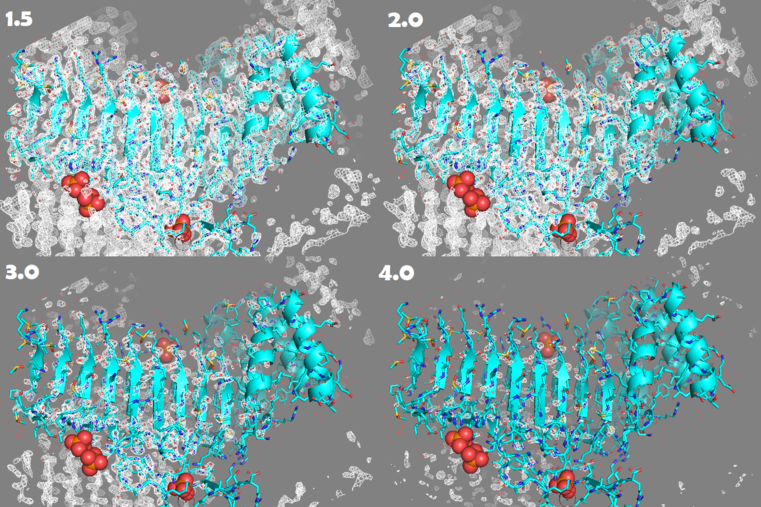
Рисунок 3. Изменение электронной плотности при увеличении уровня подрезки с 1.5 до 4.0
Заметно, что при повышении уровня подрезки не все атомы оказываются внутри поверхности электронной плотности.
Также были построены изображения электронной плотности для отдельных аминокислотных остатков. Для этого были выбраны аминокислоты, отличающиеся по структуре и функциональным группам: Ile98, His99 и Arg100.
Можно посмотреть анимацию, в которой происходит последовательное увеличение уровня обрезки с 1.5 до 4 (рисунок 4).
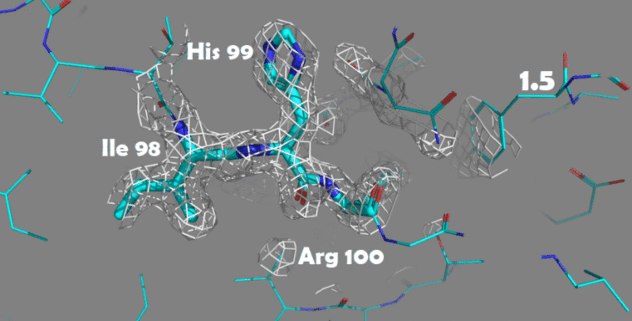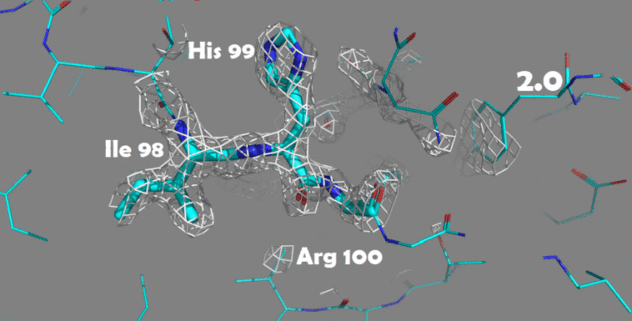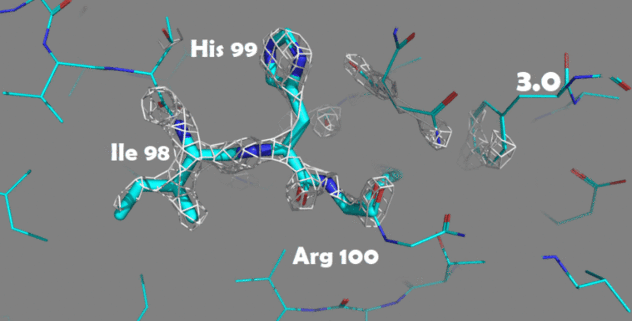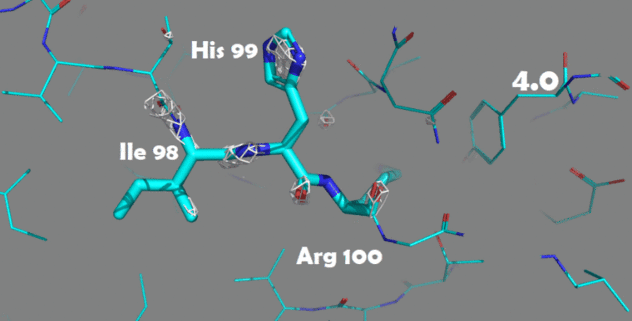
Рисунок 4. Изменение электронной плотности при увеличении уровня подрезки с 1.5 до 4.0 Атомы покрашены по одной из цветовых схем PyMol (C - голубой, N - синий, O - красный)
Для данных аминокислотных остатков по респределению электронной плотности достаточно точно можно определить положение атомов и тип аминокислоты. При увеличении уровня подрезки в первую очередь электронная плотность исчезает с C-атомов радикальных групп.
На уровне подрезки 4 в основном электронная плотность остается внутри имидазольного кольца гистидина (так как это ароматическая система), а также на электрон-избыточных атомах азота в полипептидной цепи.