Anna Zheltova
Seventh term (Седьмой семестр):
Electron density in PyMol (Электронная плотность в PyMol)
Crystal recovery in PyMol (Восстановление кристалла в PyMol)
Expansion of a function in a Fourier series (Разложение функции в ряд Фурье)
Analysis of the NMR file (Анализ ЯМР-файла)
Definition of the secondary structure (Определение вторичной структуры)
Locating hydrophobic clusters (Нахождение гидрофобных кластеров)
Surface construction and analysis in PyMOL (Построение и анализ поверхностей в PyMOL)
Сравнение трех водородных связей в структурах белка, расшифрованных с помощью ЯМР и РСА.
Был выбран белок Apaf-1 CARD, для которого есть и ЯМР, и РСА структура. Пример был взят из таблицы из статьи 2010 года. Структура, расшифрованная методом РСА, имеет идентификатор 1CY5 (разрешение 1.3 ангстрем), методом ЯМР - 1C15 (16 моделей). Укладки структур ЯМР и РСА сходны. Таким образом, данный белок удовлетворяет всем требованиям для выполнения задания.
1C15 и 1CY5 были открыты в PyMol и совмещены с помощью комманды align:
align 1c15, 1cy5
Все 16 моделей были отображены с помощью следующей команды:
set all_states, on
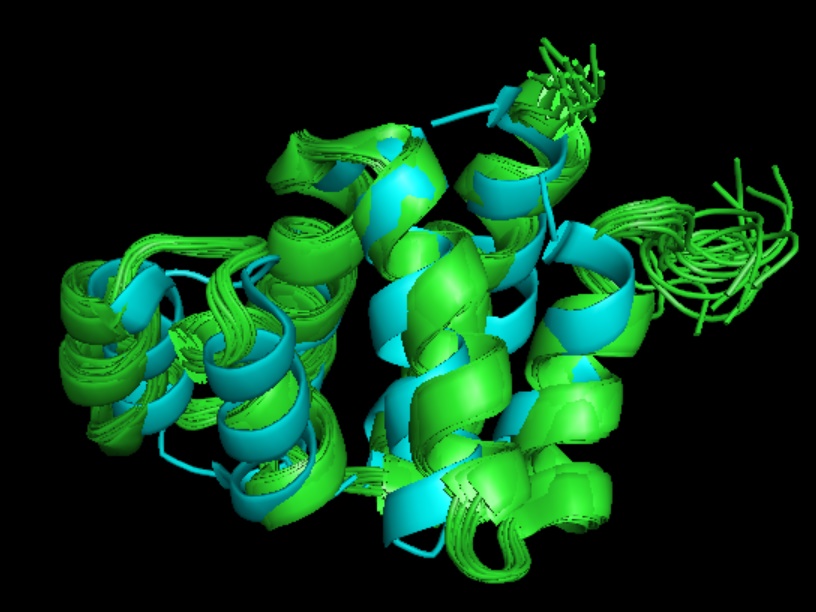
Рис.1. Результат совмещения
Из рисунка можно сделать вывод, что структуры похожи и отличаются только по положениям отдельных нитей и в районах петель.
Водородные связи для анализа в РСА.
Водородные связи были найдены с помощью PyMOL:
distance hbond, name N*, name O*, 3.5, mode=2
show sticks, 1cy5&resn Ser+Thr+Cys+Asn+Gln+Tyr+Asp+Glu+Lys+Arg+His
В структуре, расшифрованной с помощью РСА было выбрано 3 примера водородных связей:
Chain A: GLU`17/N - ARG`13/O - остовная в альфа-спирали (рис.2);
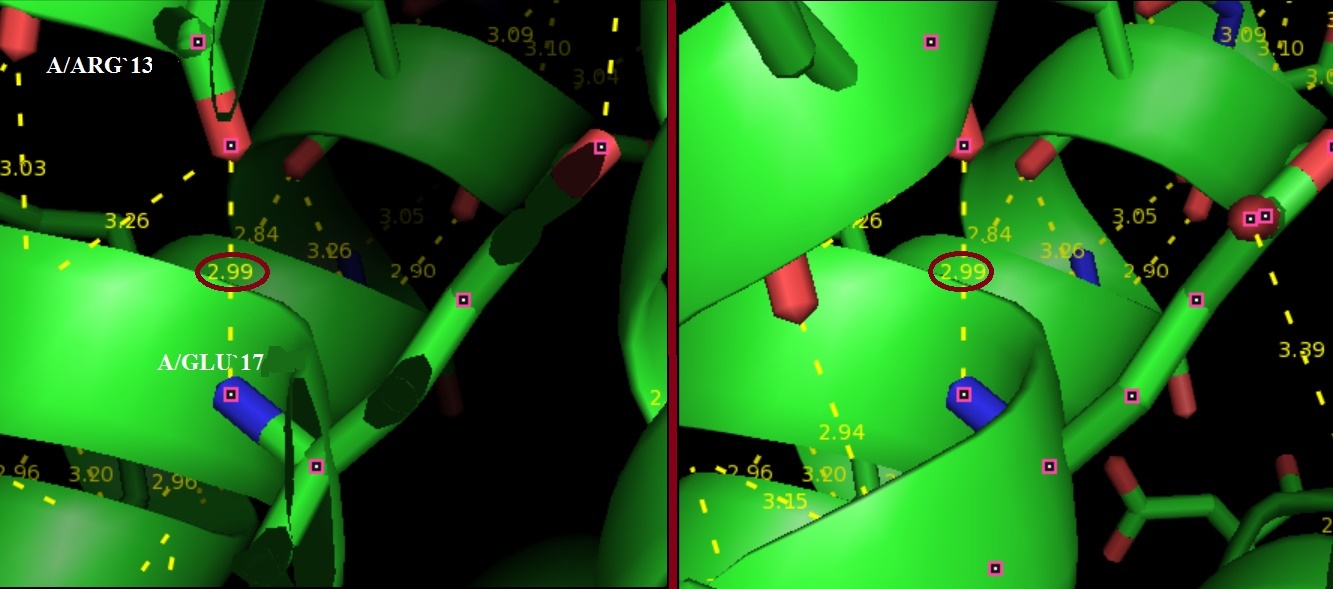
Рис.2. Остовная водородная связь в альфа-спирали. Рассматриваемая связь выделена красным.
Водородную связь боковых цепей в ядре белка было сложно найти; была рассмотрена связь: Chain A LYS`21/N - TYR`80/OH
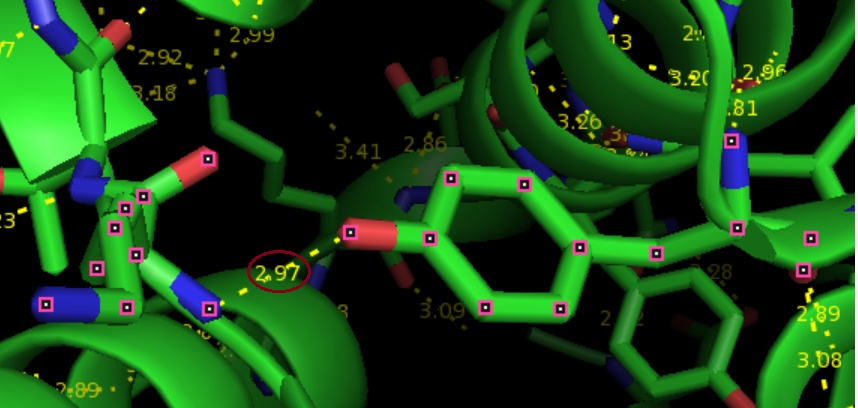
Рис.3. водородная связь боковых цепей в ядре белка. Рассматриваемая связь выделена красным.
Chain A: GLN`50/NE2 - GLU`17/OE1- водородная связь в петлях, выходящих на поверхность глобулы.
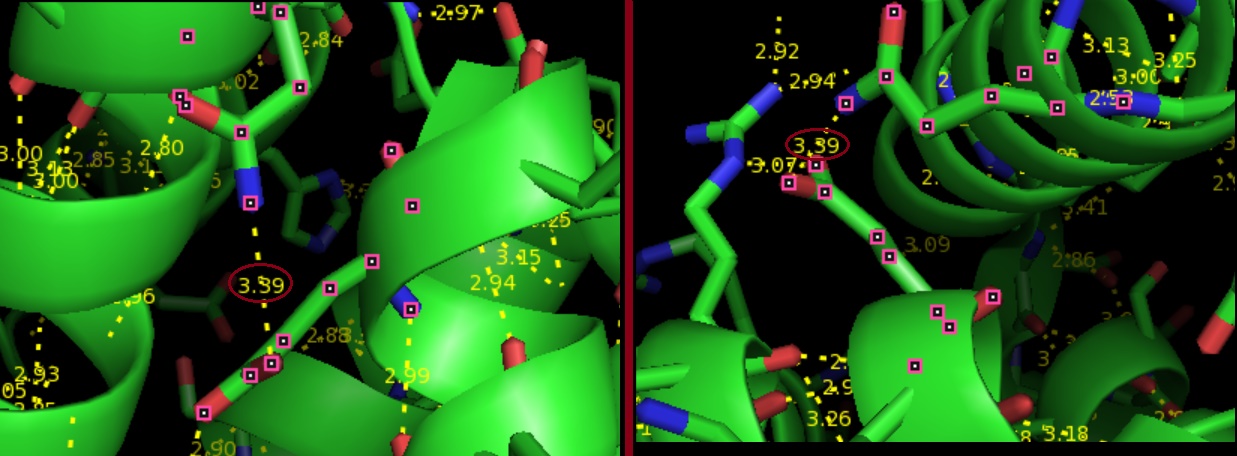
Рис.4.Водородная связь в петлях, выходящих на поверхность глобулы.Рассматриваемая связь выделена красным.
Сравнение водородных связей по данным РСА и ЯМР представлено в таблице 1:
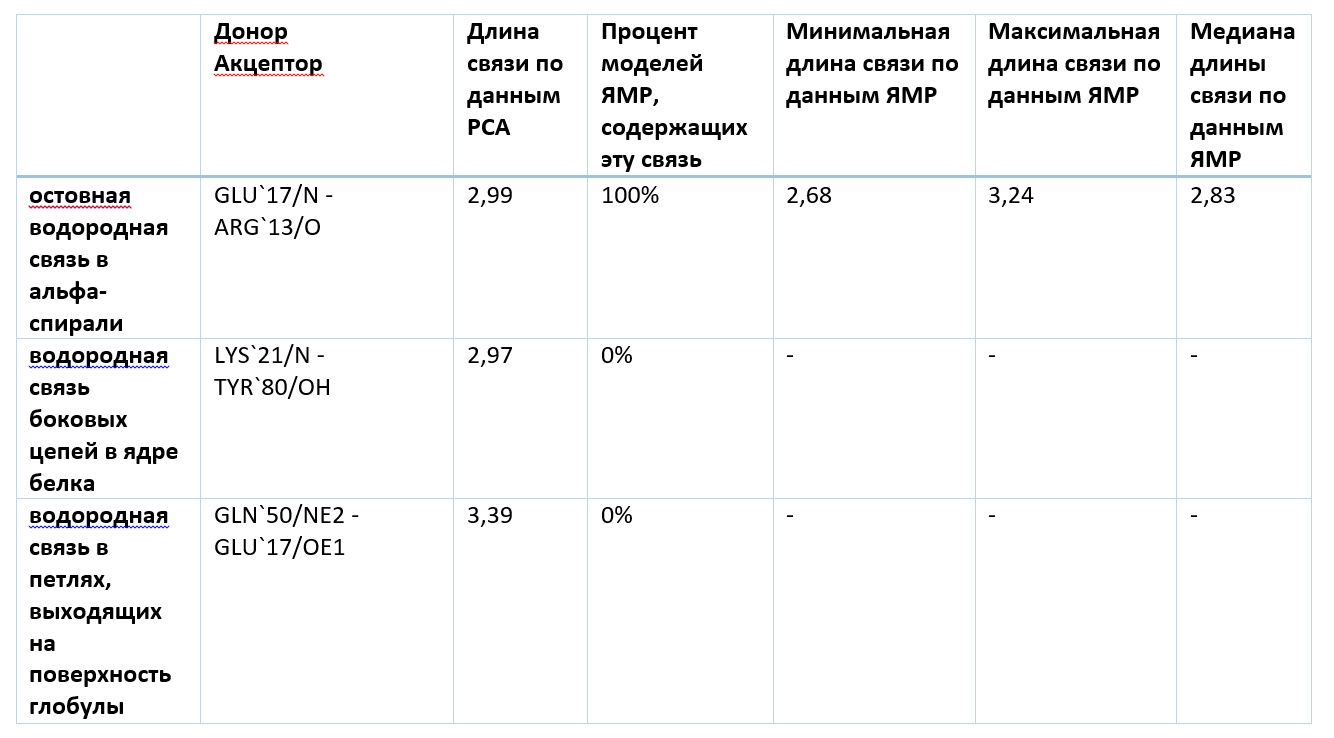
На основании полученных данных можно сделать следующие выводы:
1. Остовная водородная связь в альфа-спирали присутствует во всех моделях ЯМР и её длина практически постоянна. Данная связь стабилизирует альфа-спираль и следовательно она важна для поддержания структуры и имеет фиксированную длину.
2. Оставшиеся водородная связь не содержатся ни в одной модели ЯМР. Вероятно, данная ориентация остатков в структуре РСА появляется в результате кристаллизации и является артефактом.