Учебный сайт Фроловой Анастасии
Семестр 7. Биоинформатика в 3D.
Сравнение водородных связей было проведено на циклофилине А, который был расшифрован методами РСА (1W8L) и ЯМР (1OCA). Структура белка, полученная методом РСА, имеет разрешение 1,8 Å. ЯМР структура имеет 20 моделей. На рисунках 1 и 2 представлены структуры РСА и ЯМР, соответственно. Как видно, у них сходные пространственные укладки. По различным моделям ЯМР можно заметить, что наибольшее совпадение в альфа и бета структурах, а концевые части белка находятся в большем движении.
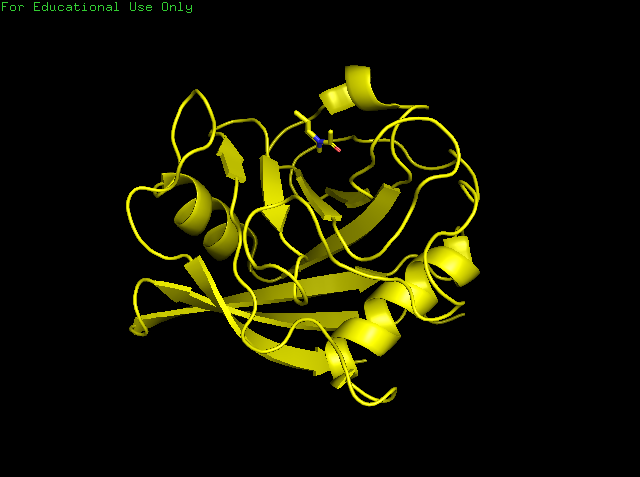
Рисунок 1. Структура 1W8L, полученная методом РСА.
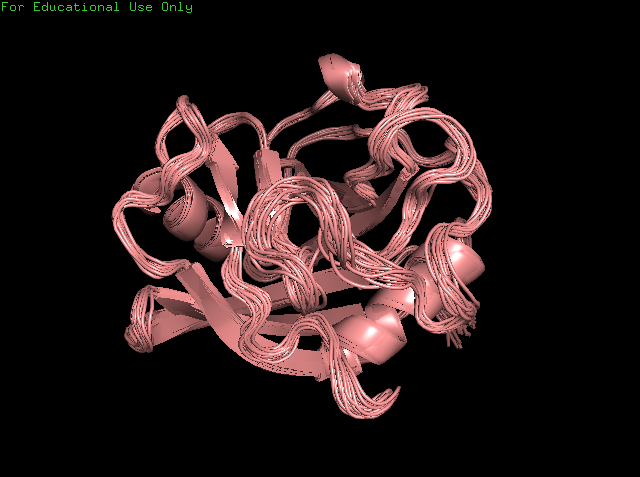
Рисунок 2. Структура 1OCA с двадцатью моделями, полученными методом ЯМР.
Я выбрала 3 разные водородные связи для анализа в РСА. Это водородные связи в бета структуре (рис.3), боковой цепи в ядре белка (рис.4) и в петле, выходящей на поверхность глобулы (рис.5).
Мы считаем, что между донором протона и акцептором есть водородная связь, если расстояние между ними меньше 3,5 ангстрем. Кроме этого, воображаемый водород должен быть на линии донор-акцептор или не сильно отклонятся от этой линии (угол между донор-акцептором и донор-водородом, акцептор-донор и акцептор-водородом был не более 70°.
Между аминокислотами Ser99 и Phe113 в бета структуре образуется две водородные связи:Ser99(N) - Phe113(O), Ser99(O) - Phe113(N), с длинами 3 и 2,9 Å. Анализ водородной связи был проведен на Ser99(N) и Phe113(O) (Рис.3).
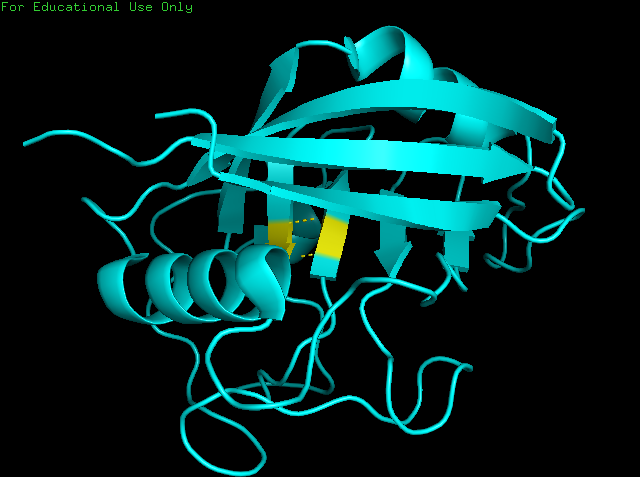
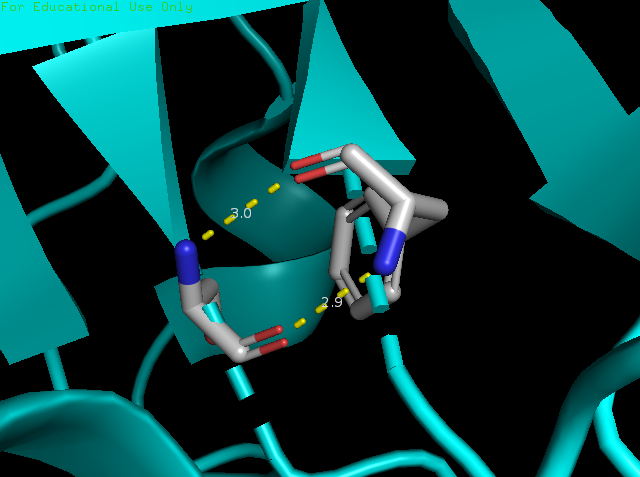
Рисунок 3. Водородные связи между остатками Ser99 и Phe113 в бета-листе.
Для просмотра водородной связи боковых цепей я вдре белка я выбрала Leu98 (N) и Gly130 (O). Длина водородной связи 3 Å (рис.4).
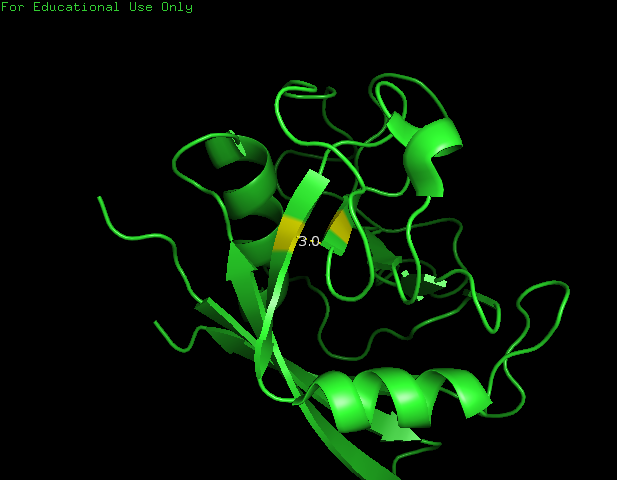
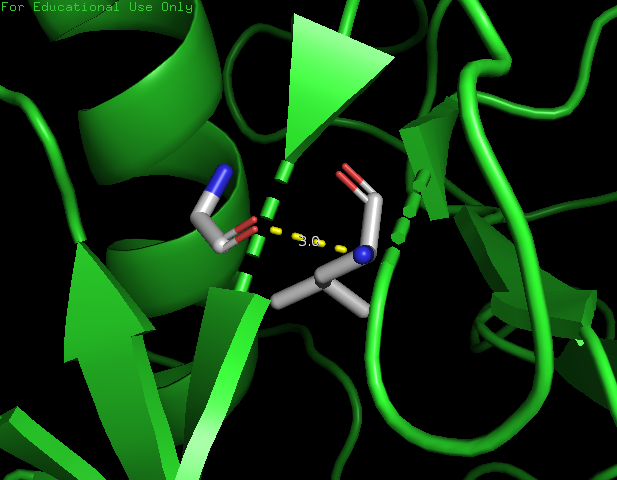
Рисунок 4. Водородная связь между Leu98 и Gly130 боковых цепей в ядре белка.
На рисунках ниже представлены аминокислоты, которые расположены в боковой петле, выходящей на поверхность глобулы. Аминокислоты Asn87 (OD1) и Ile89 (N) имеют водородную связь с длиной 3,2 Å (рис.5).
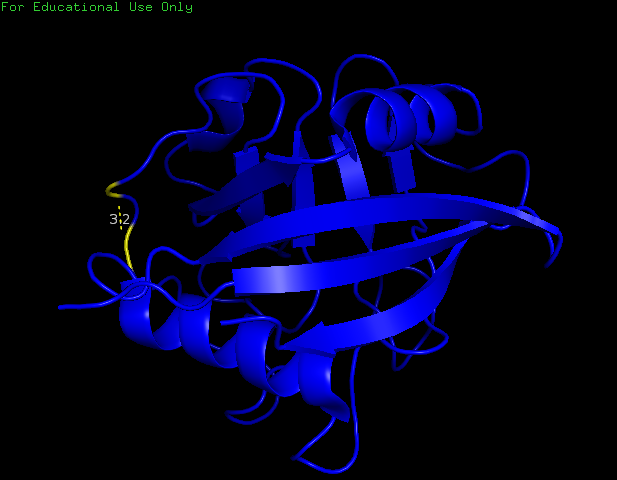
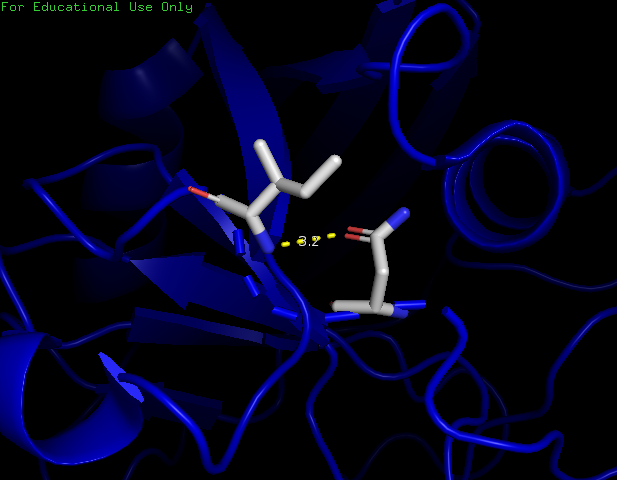
Рисунок 5. Водородная связь между Asn87 и Ile89 в боковой петле.
В результате ЯМР эксперимента получается некоторое количество возможных моделей белка, которые предоставлены PDB файле. Основной задачей является сравнение водородных связей структур, полученных методами ЯМР и РСА. В таблице ниже представлены подсчитанные длины водородных связей между молекулами в разных частях структуры белка.
Таблица 1. Значения водородных связей в структурах 1OCA (ЯМР) и 1W8L(РСА).
| № | Аминокислоты | Расстояние (РСА) | %моделей с водородной связью | минимальное значение расстояния ЯМР | максимальное значение расстояния ЯМР | медианное значение расстояния ЯМР |
| 1 | Ser99 (N) - Phe113 (O) | 3 | 100 | 2.92 | 3.35 | 3.02 |
| 2 | Leu98 (N) - Gly130 (O) | 3 | 100 | 2.82 | 2.94 | 2.83 |
| 3 | Asn87 (OD1) - Ile89 (N) | 3.2 | 50 | 2,924 | 3,43 | 3.17 |
Водородные связи между аминокислотами в разных местах белка имеют определенные длины. В случаях, когда эта связь в ядре белка, то она присутствует во всех 20 моделях. Но для последнего примера, где аминокислоты расположены в боковой петле, расположенной на поверхности глобулы, водородная связь есть только в 50% (10/20 моделях).