|
|
|
|
В PDB-файле для структуры Cu,Zn-супероксиддисмутазы (1PU0) указаны
параметры элементарной ячейки кристалла в поле CRYST1: Структура кристалла Cu,Zn-СОД представлена на рисунках 1 (красным отмечена одна асимметрическая единица) и 2 (показаны границы элементарной ячейки). 
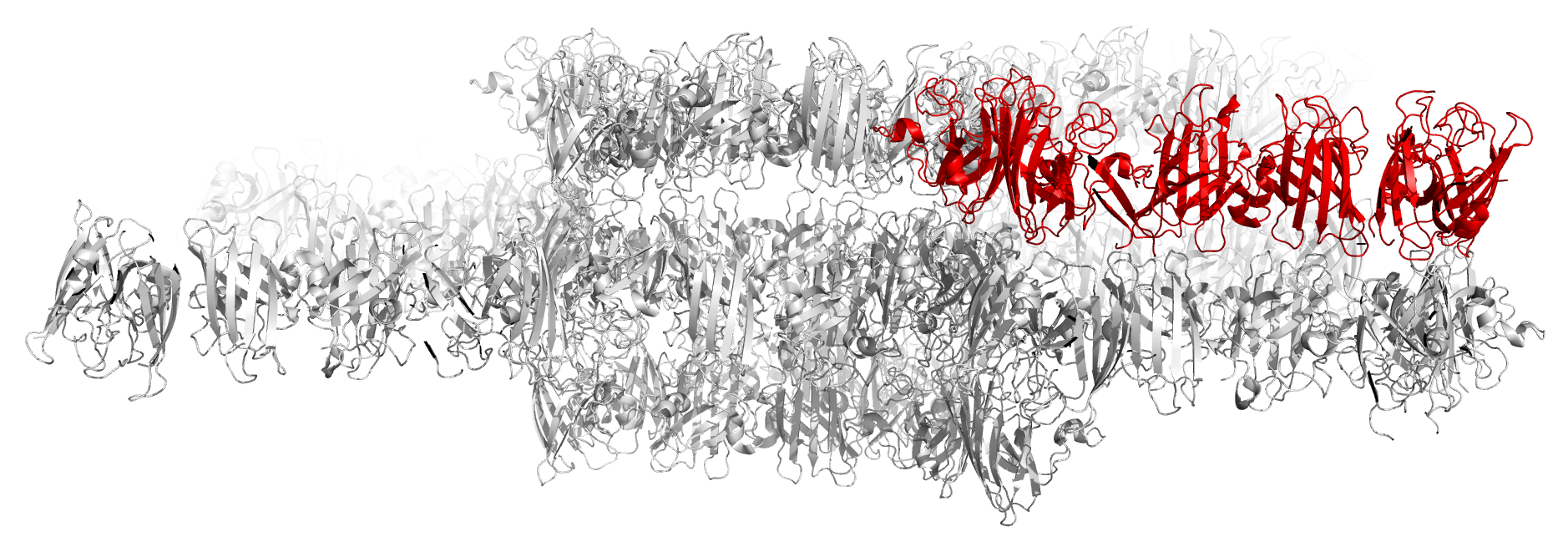
Рисунок 1. Структура кристалла Cu,Zn-СОД в разных проекциях (построена функцией symexp с отображением соседних структур на расстоянии 5 Å). Красным отмечена одна асимметрическая единица. 
Рисунок 2. Структура кристалла Cu,Zn-СОД (построена функцией symexp с отображением соседних структур на расстоянии 10 Å). Изображены границы элементарной ячейки. Взаимодействия между молекулами белка
Cu,Zn-СОД является гомодимером. В состав асимметрической ячейки входит 10 мономеров (и, соответственно, 5 димеров
белка), поэтому взаимодействия между разными асимметрическими единицами или между белками из разных элементарных ячеек
не будут отражать естественные контакты между мономерами при образовании биологически активной единицы. Однако
известно, что Cu,Zn-СОД склонна к олигомеризации и образованию филаментоподобных структур, поэтому можно исследовать контакты
между разными димерами белка в кристалле.
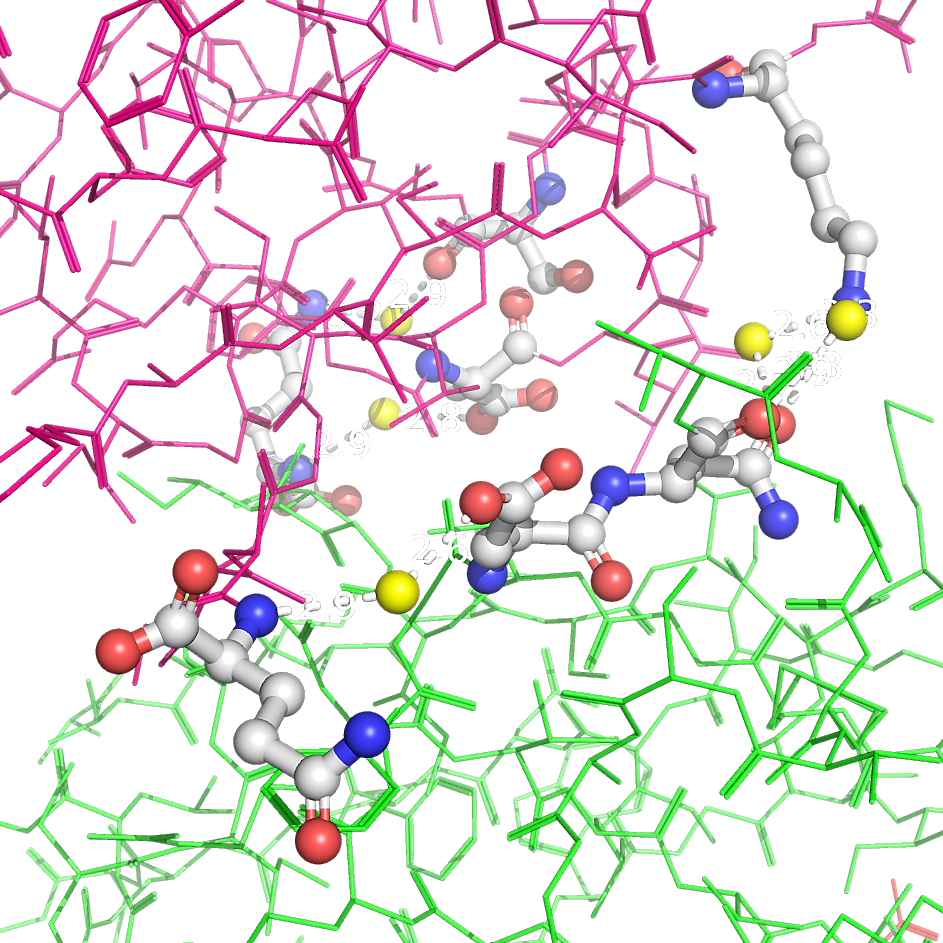
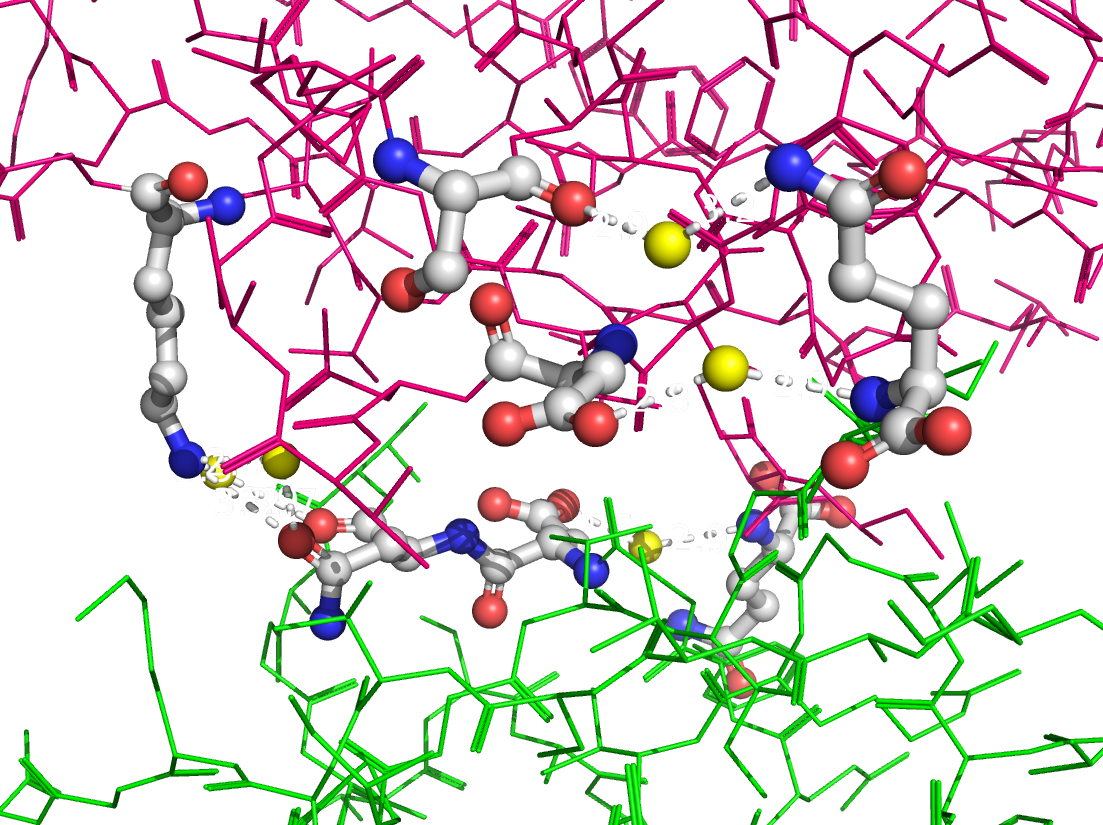
Рисунок 3. Полярные контакты между субъединицами Cu,Zn-СОД при димеризации. Разные субъединицы отмечены зеленым и розовым цветом. Аминокислотные остатки, участвующие в образовании водородных связей, выделены и покрашены по стандартной цветовой схеме PyMol по типу атома (C - серый, N - синий, O - красный). Водородные связи (построены с порогом по длине связи не более 3.5 Å) отмечены белыми пунктирными линиями. Молекулы воды показаны желтыми шариками. 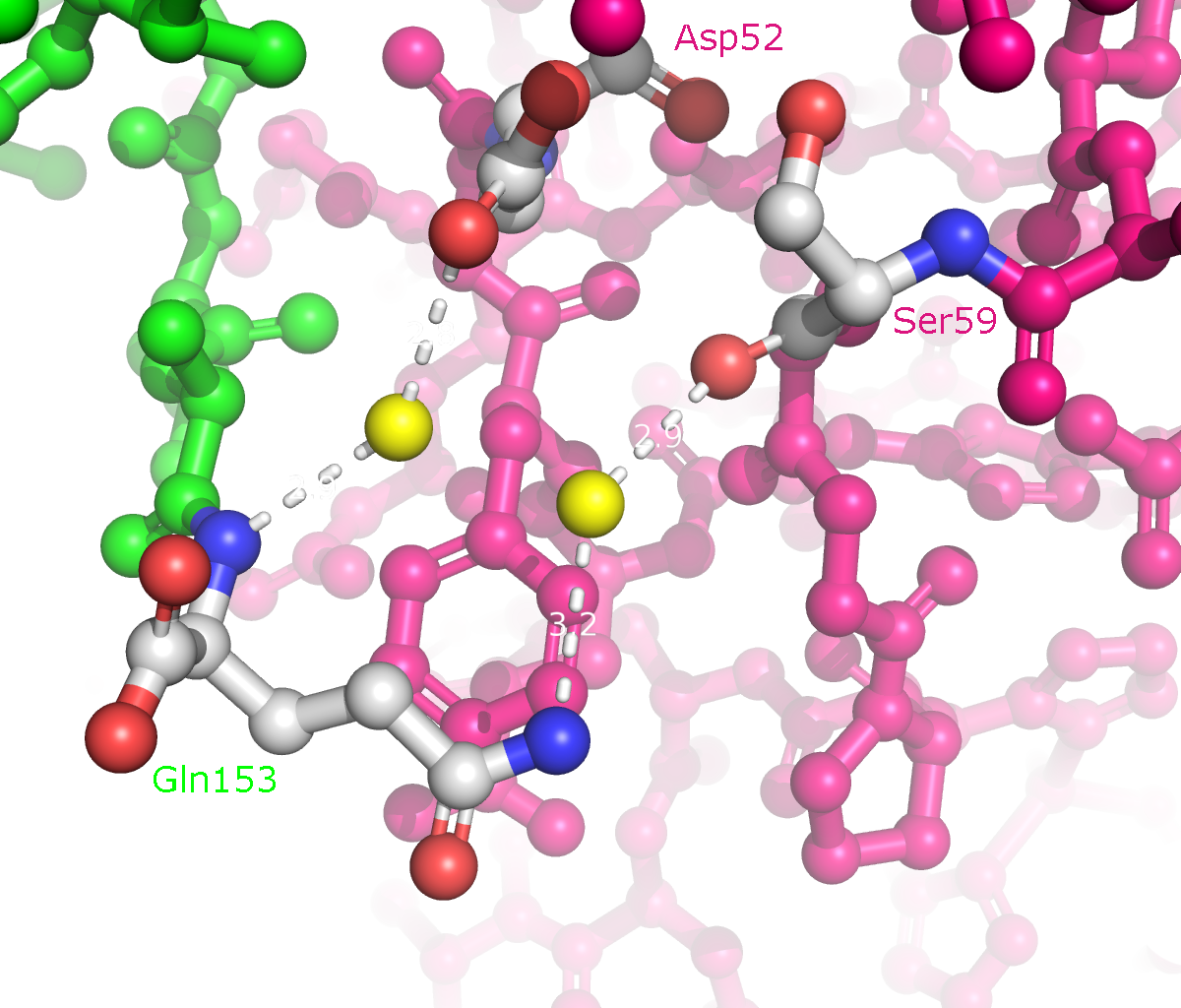
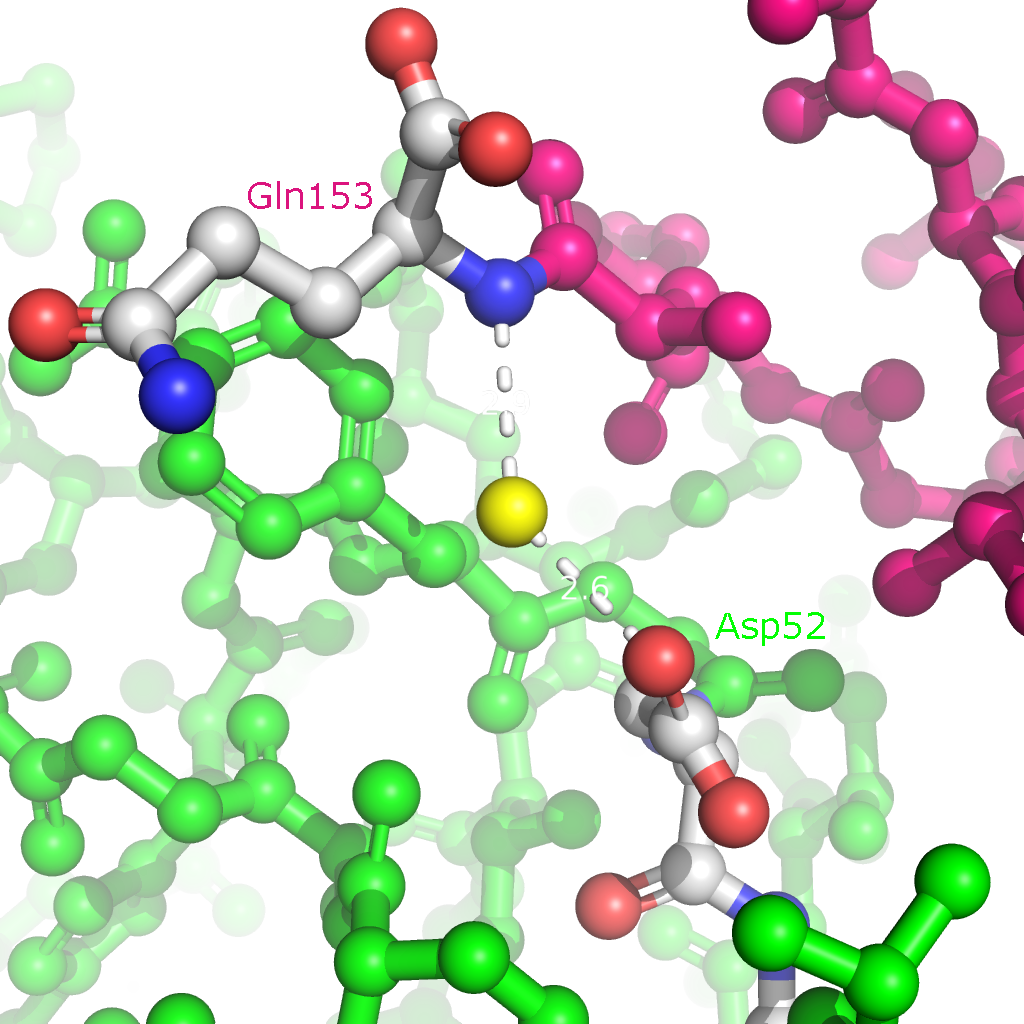
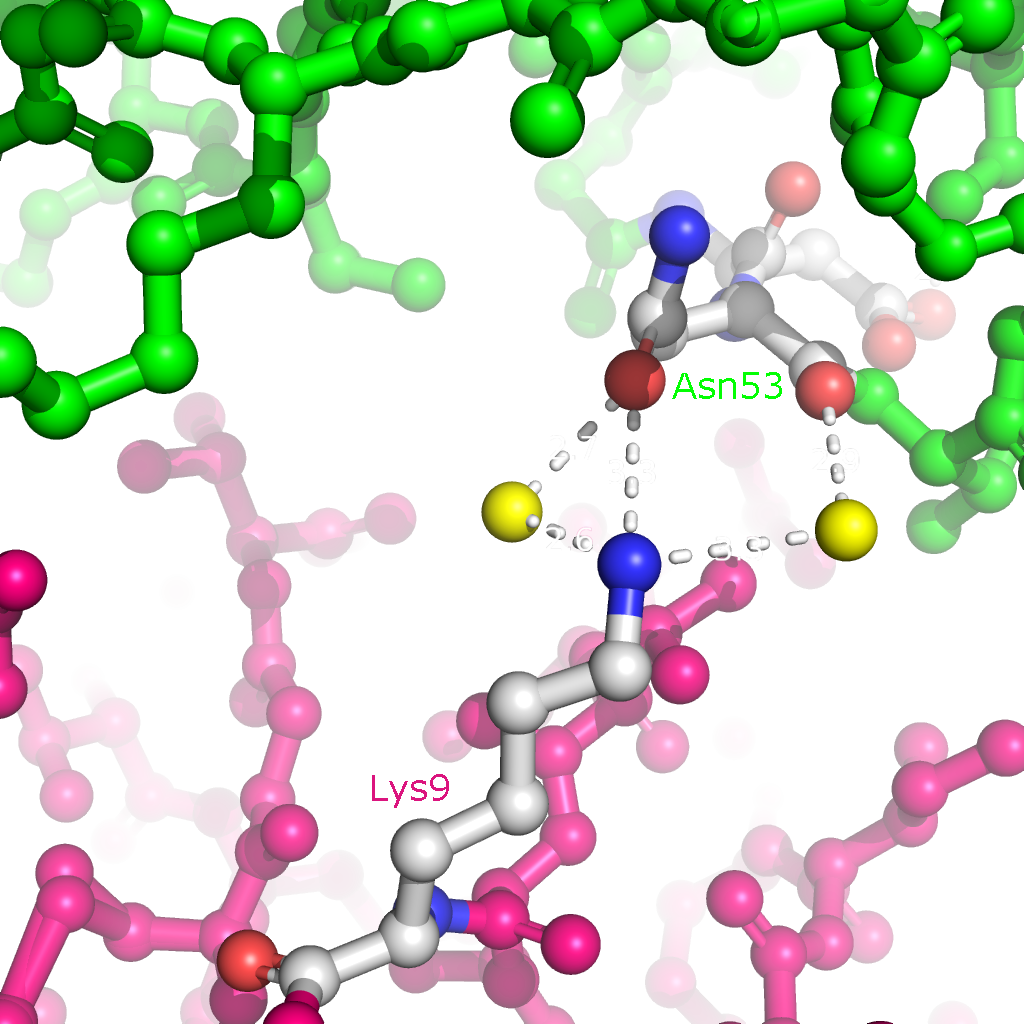
Рисунок 4. Полярные контакты между субъединицами Cu,Zn-СОД при димеризации. Номера остатков, принимающих участие в образовании водородных связей, подписаны и обозначены цветом, соответствующим цвету белковой цепи. В одной из статей были определены остатки, участвующие в образовании димера Cu,Zn-СОД. По результатам моделирования с использованием квантовых расчетов взаимодействия при димеризации обеспечиваются Ile151, Gly114 и Gly51 (контакт симметричен). Водородные связи образуются между атомами остова белковой цепи, поэтому эти взаимодействия не были обнаружены при поиске полярных контактов. На рисунке 5 представлены водородные связи между этими остатками в димере. 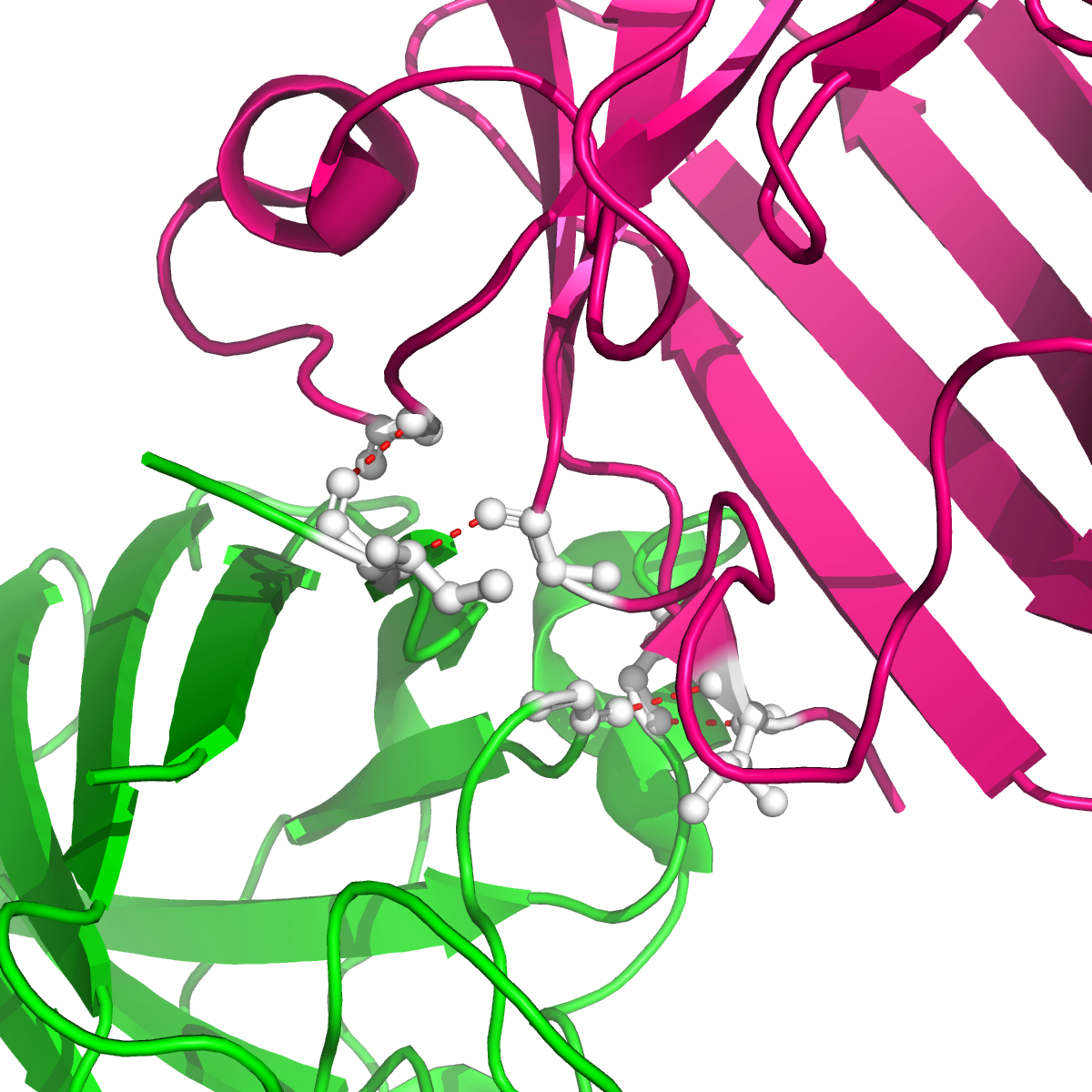
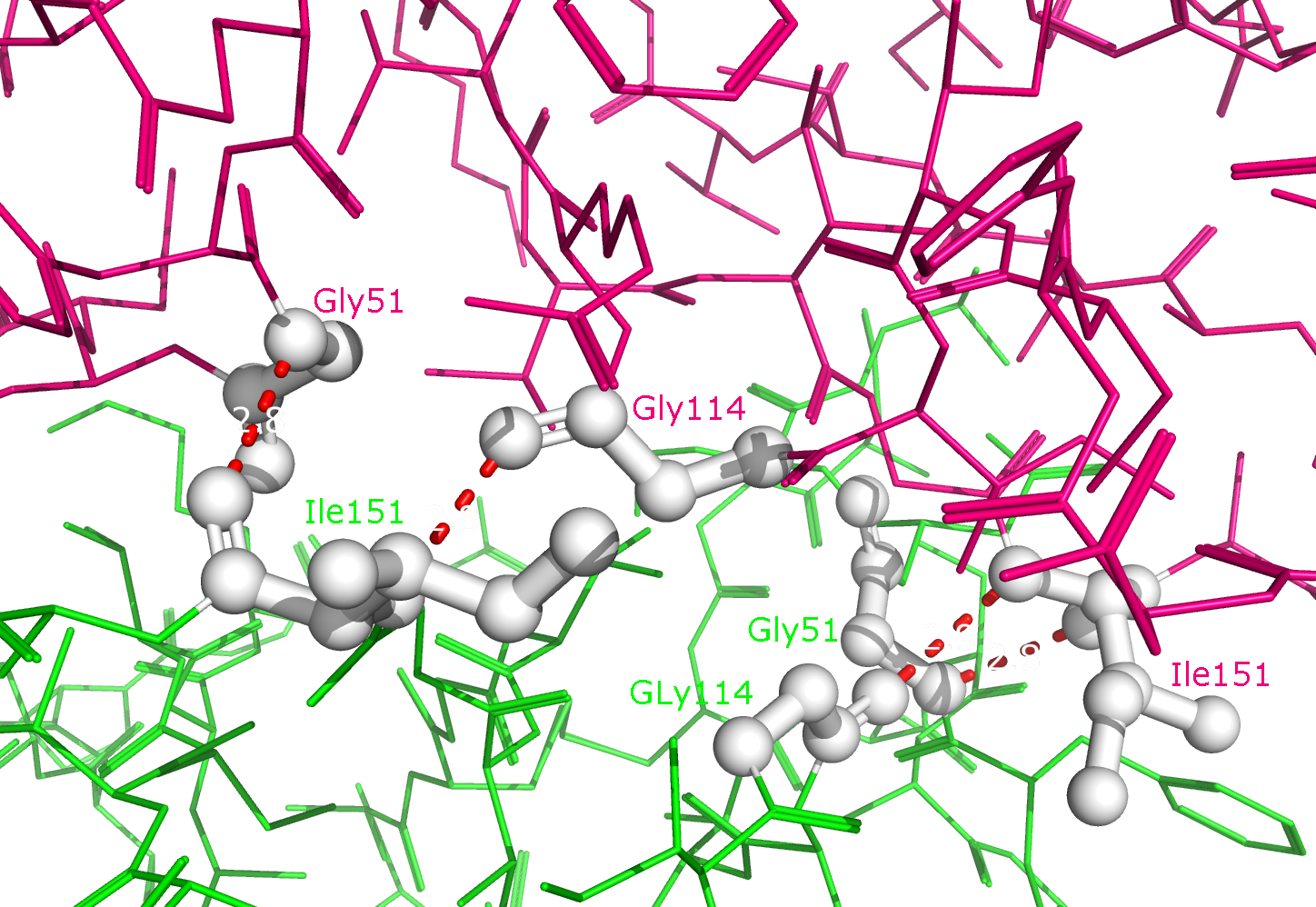
Рисунок 5. Полярные контакты между субъединицами Cu,Zn-СОД при димеризации по данным статьи. Разные субъединицы отмечены зеленым и розовым цветом. Аминокислотные остатки, участвующие в образовании водородных связей, выделены белым. Водородные связи (построены с порогом по длине связи не более 3.5 Å) отмечены красными пунктирными линиями. Номера остатков, принимающих участие в образовании водородных связей, подписаны и обозначены цветом, соответствующим цвету белковой цепи.
Далее были проанализированы взаимодействия между двумя димерами в одной асимметрической ячейке. На рисунках 6 и 7 представлены
зоны контакта цепей B и D (отмечены синим и зеленым) в целом, а также с указанием конкретных аминокислотных остатков. В образовании
водородных связей принимают участие Lys75, Asp76, Asn86, Thr88, Asp96, Ser98, Asp125, Lys128, Asn131 и Glu132. Ни один из этих
остатков не участвует в димеризации субъединиц, однако можно заметить, что контакты в обоих случаях в основном обеспечиваются
органиченным набором аминокислот (Lys, Asp, Asn, Glu, Gln, Ser и Thr).
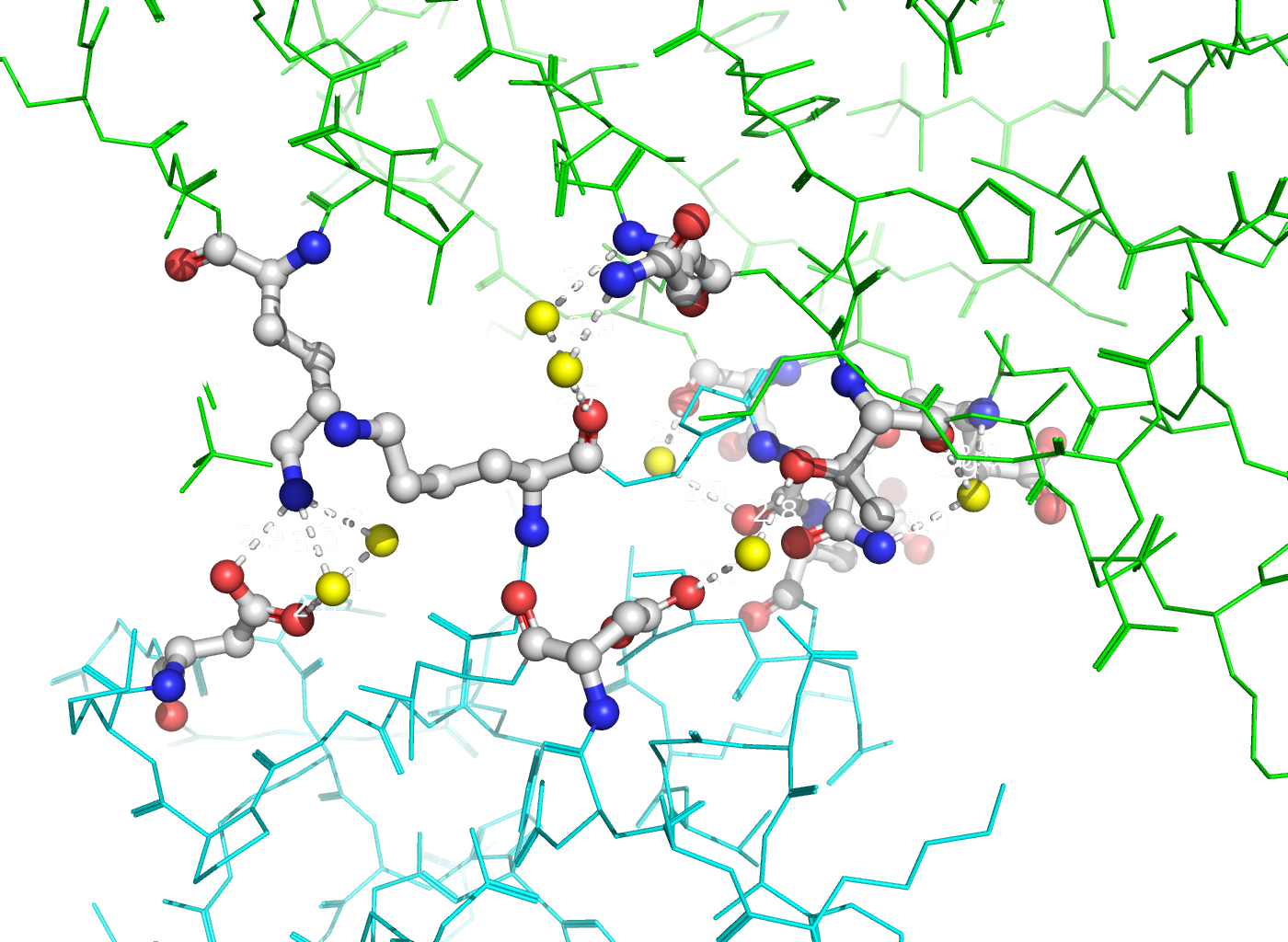
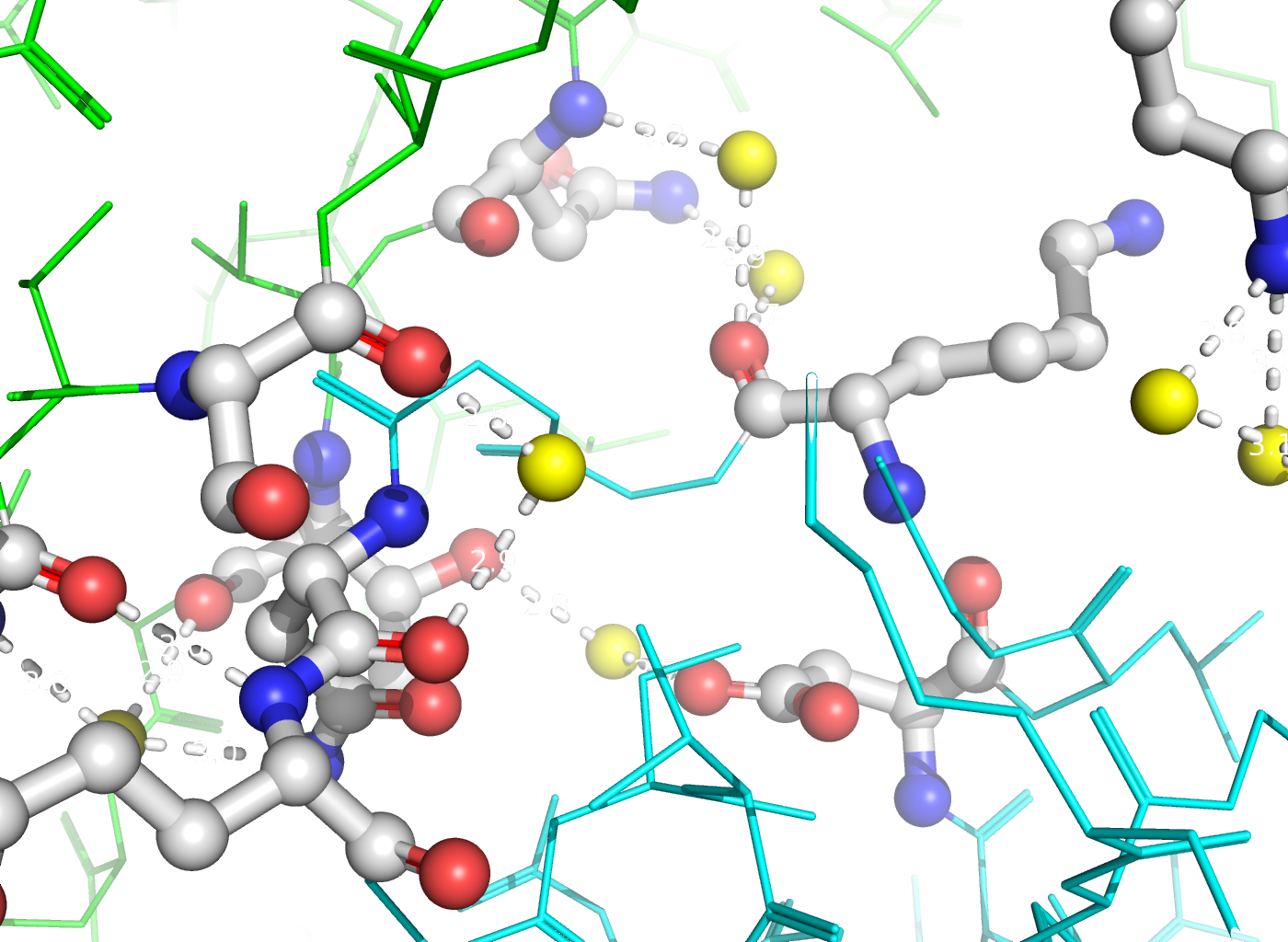
Рисунок 6. Полярные контакты между двумя димерами Cu,Zn-СОД. Разные субъединицы отмечены зеленым и синим цветом. Аминокислотные остатки, участвующие в образовании водородных связей, выделены и покрашены по стандартной цветовой схеме PyMol по типу атома (C - серый, N - синий, O - красный). Водородные связи (построены с порогом по длине связи не более 3.5 Å) отмечены белыми пунктирными линиями. Молекулы воды показаны желтыми шариками. 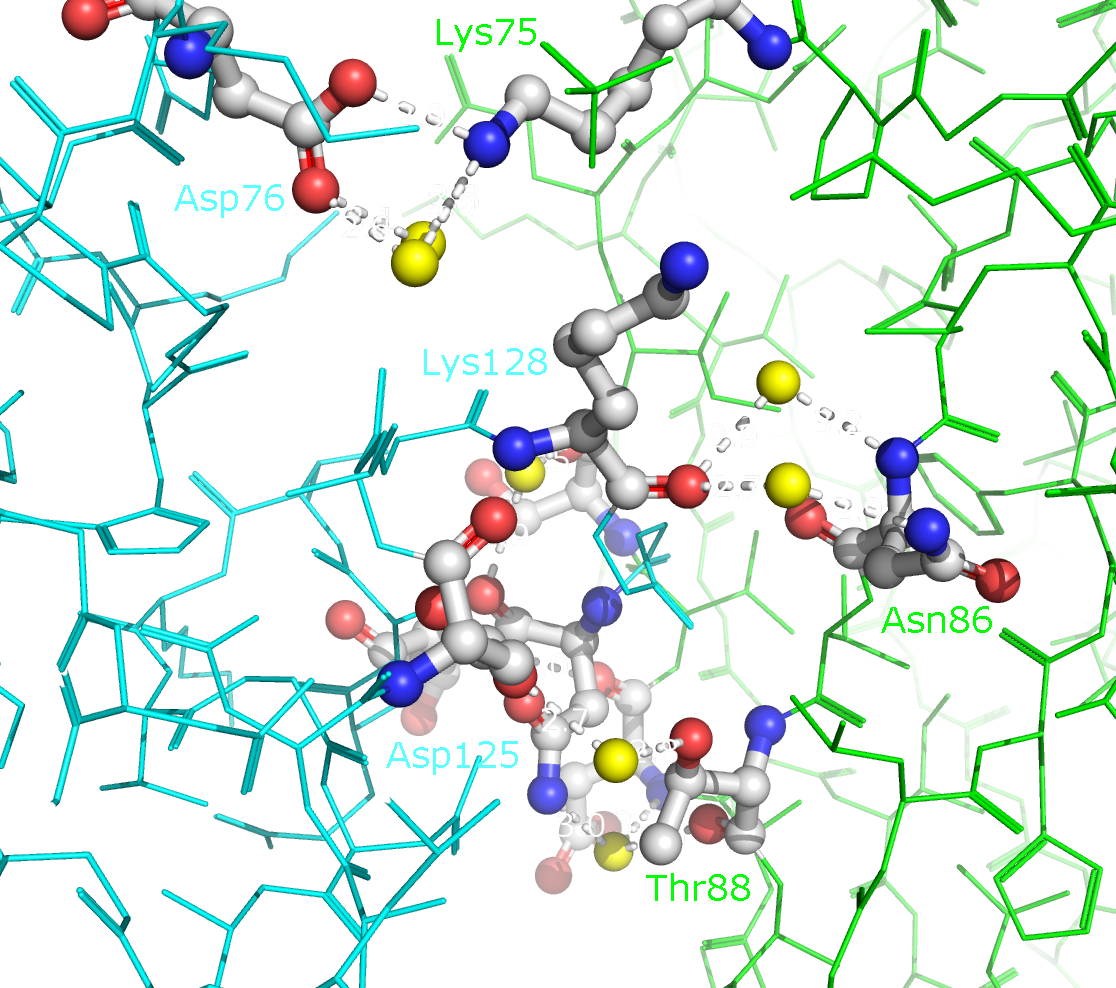
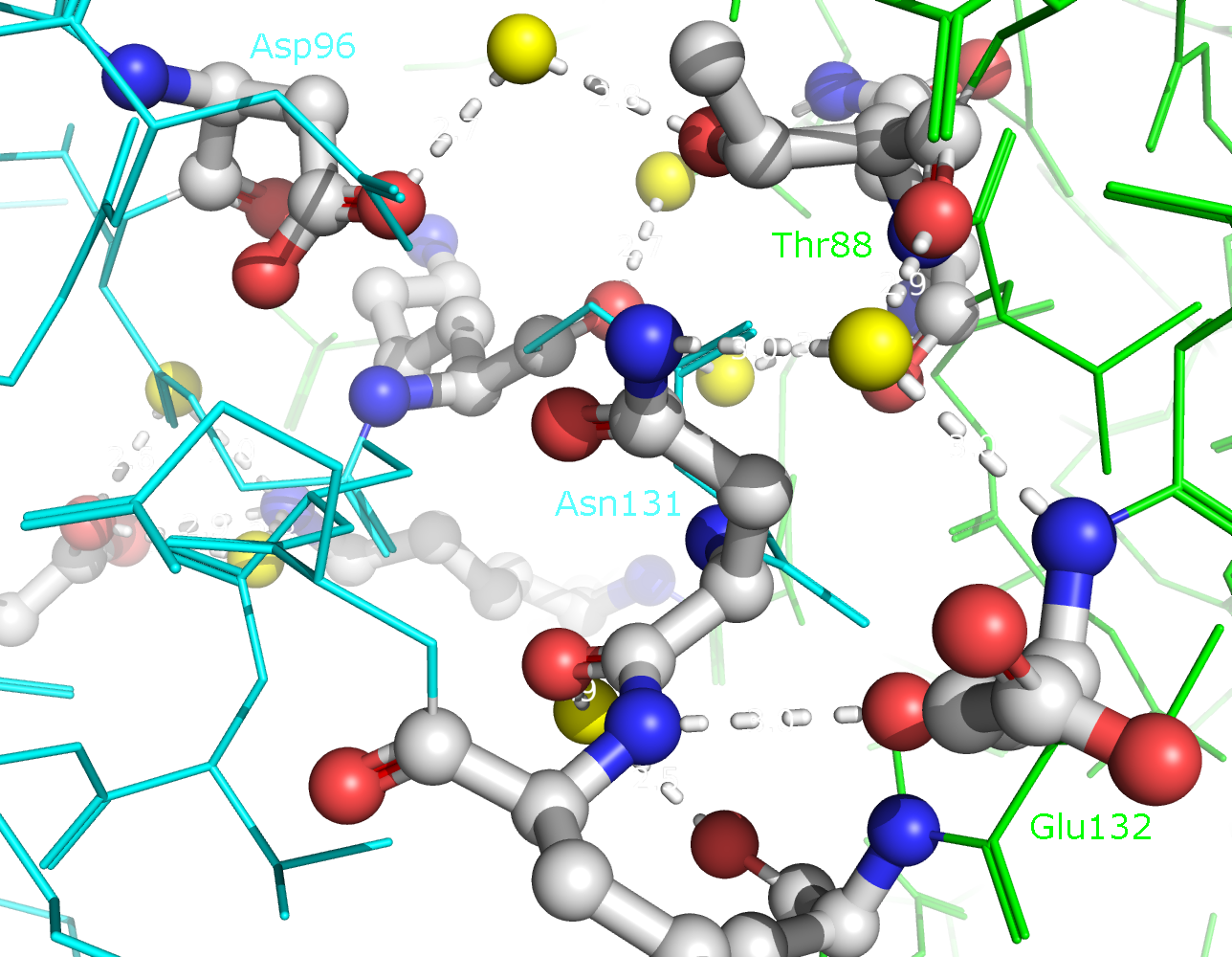
Рисунок 7. Полярные контакты между двумя димерами Cu,Zn-СОД. Номера остатков, принимающих участие в образовании водородных связей, подписаны и обозначены цветом, соответствующим цвету белковой цепи. Наконец, я изобразила взаимодействия между разными асимметрическими ячейками. Такие взаимодействия могут быть двух типов (рисунок 8). 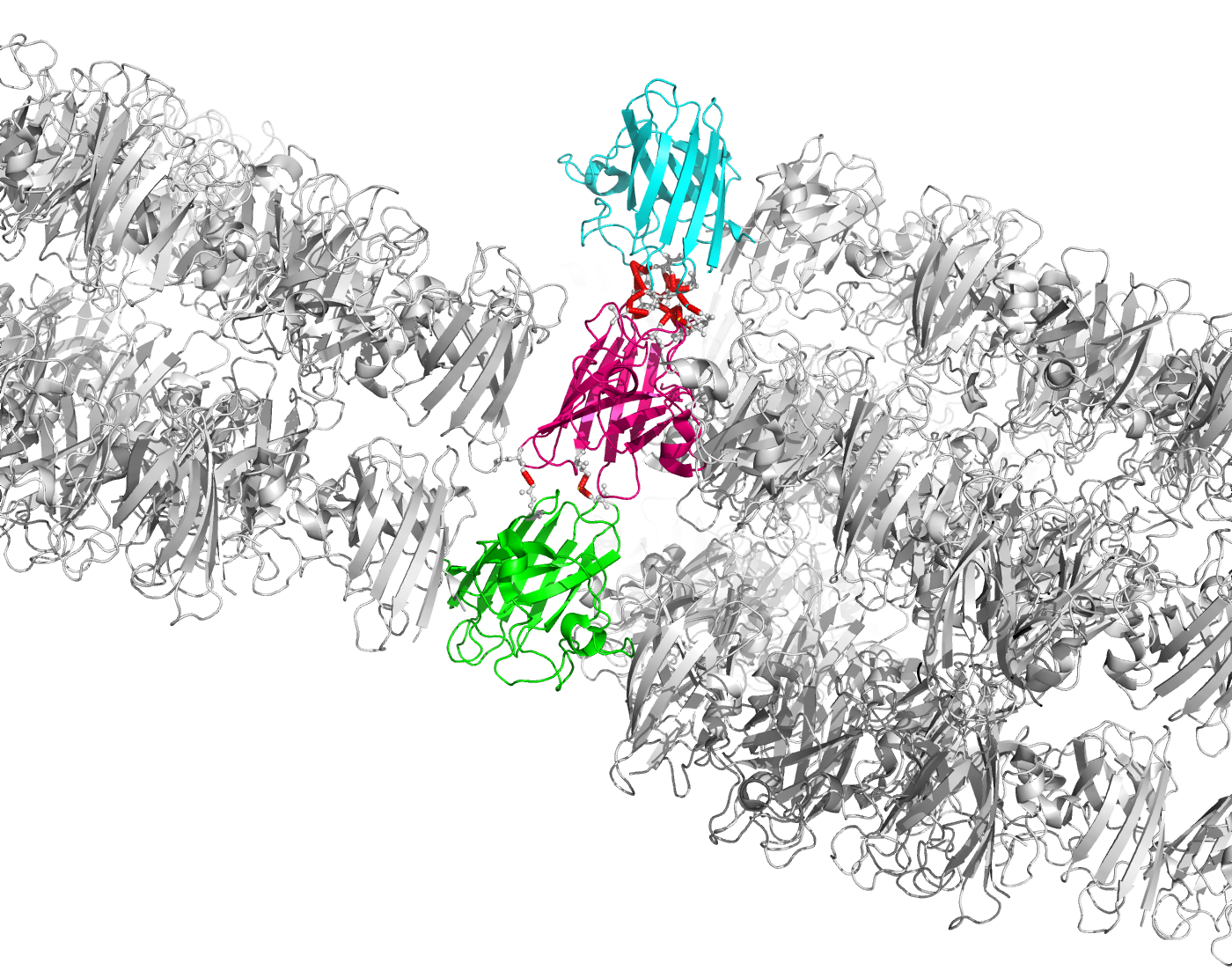
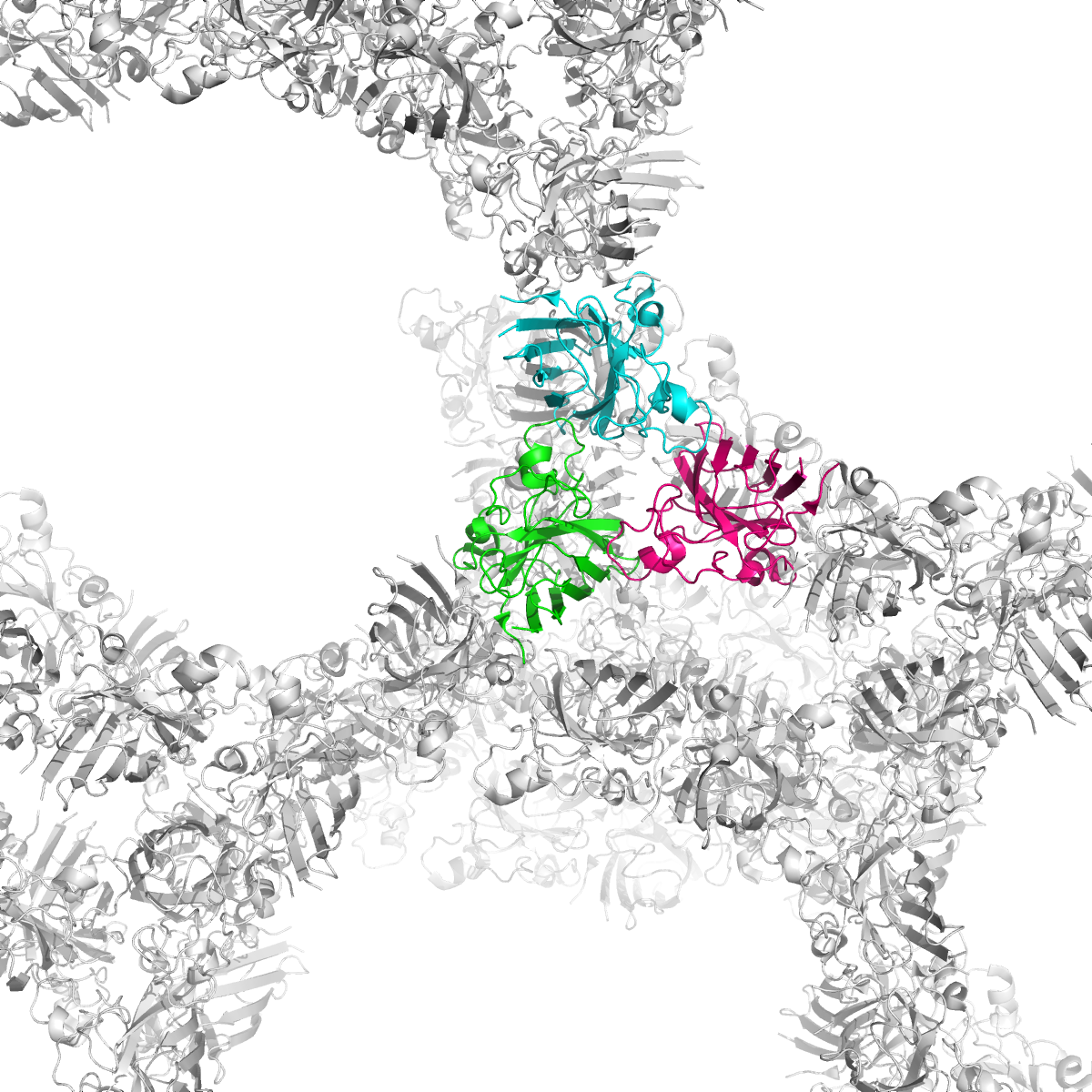
Рисунок 8a. Два типа контактов между асимметрическими единицами: вертикальные (сверху) и боковые (снизу). Субъединицы, контакты между которыми будут потом рассматриваться, покрашены в синий, розовый и зеленый. 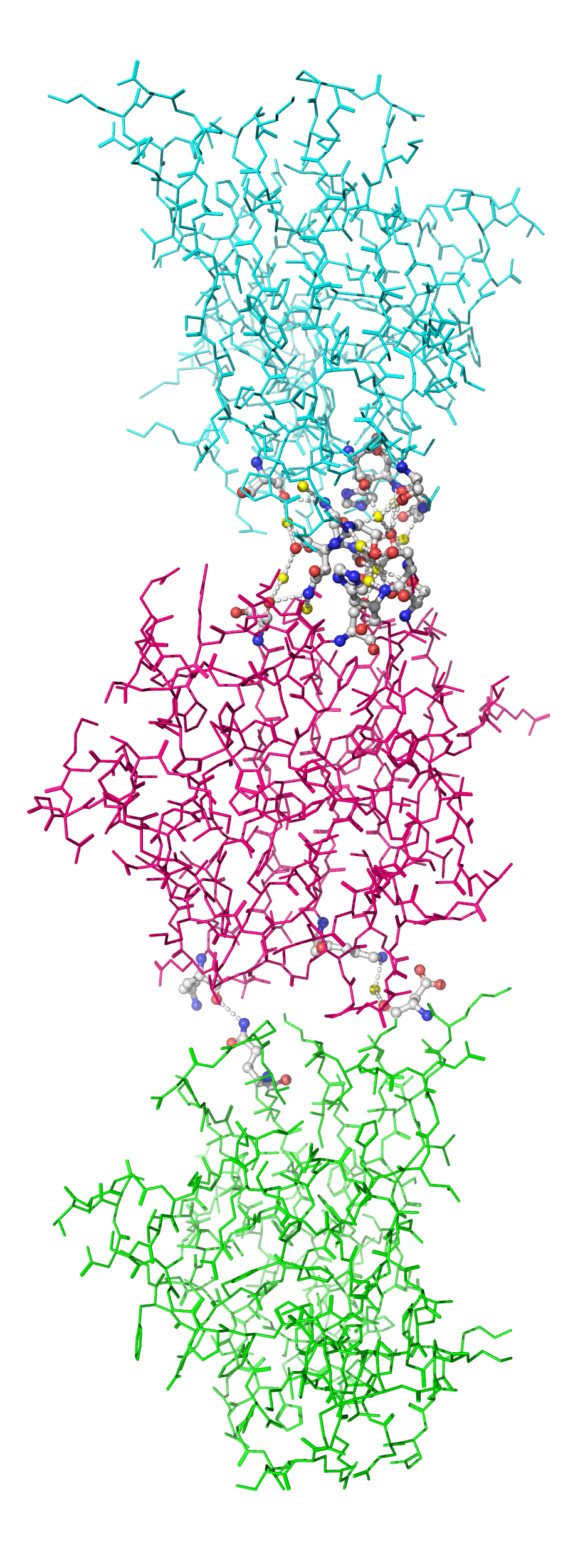
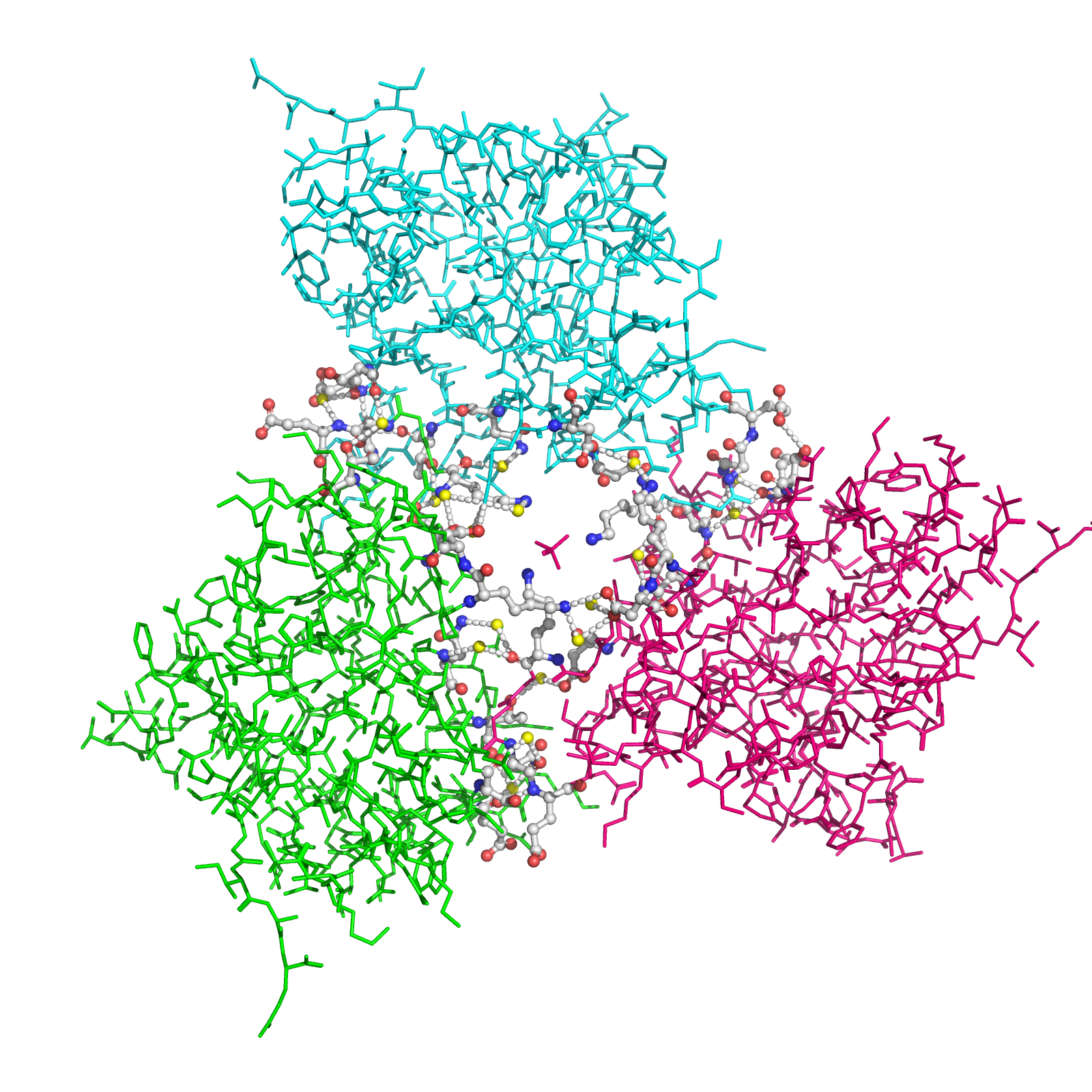
Рисунок 8b. Контакты между отмеченными субъединицами. Водородные связи отмечены белыми пунктирными линиями, атомы воды - желтыми шариками. Взаимодействующие аминокислоты отмечены и покрашены в соответствии со стандартной цветовой схемой PyMol по типу атома (C - серый, N - синий, O - красный).
Подробнее рассмотрим контакты каждого из типов.
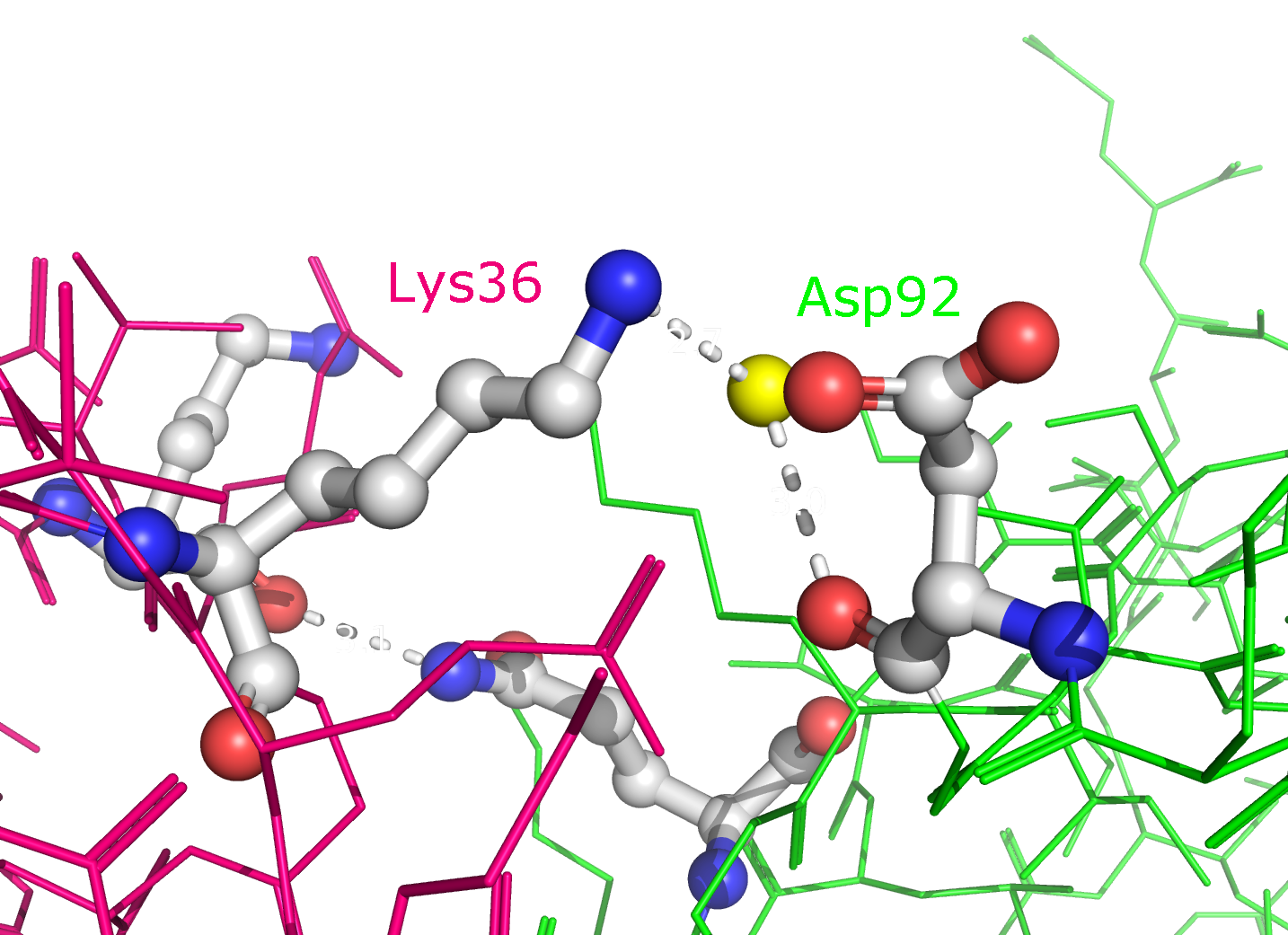
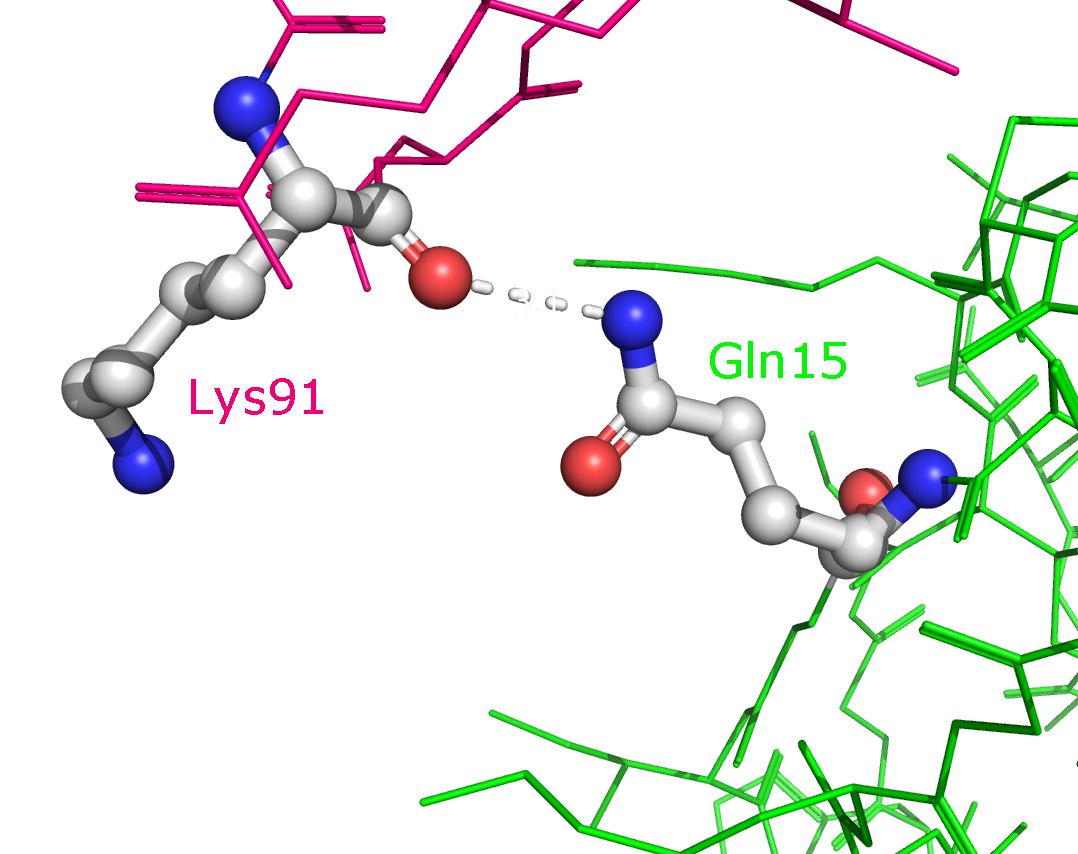
Рисунок 9a. Полярные контакты между розовой и зеленой субъединицами. Водородные связи отмечены белыми пунктирными линиями, атомы воды - желтыми шариками. Взаимодействующие аминокислоты отмечены и покрашены по стандартной цветовой схеме PyMol по типу атома (C - серый, N - синий, O - красный). Номера остатков, принимающих участие в образовании водородных связей, подписаны и обозначены цветом, соответствующим цвету белковой цепи. 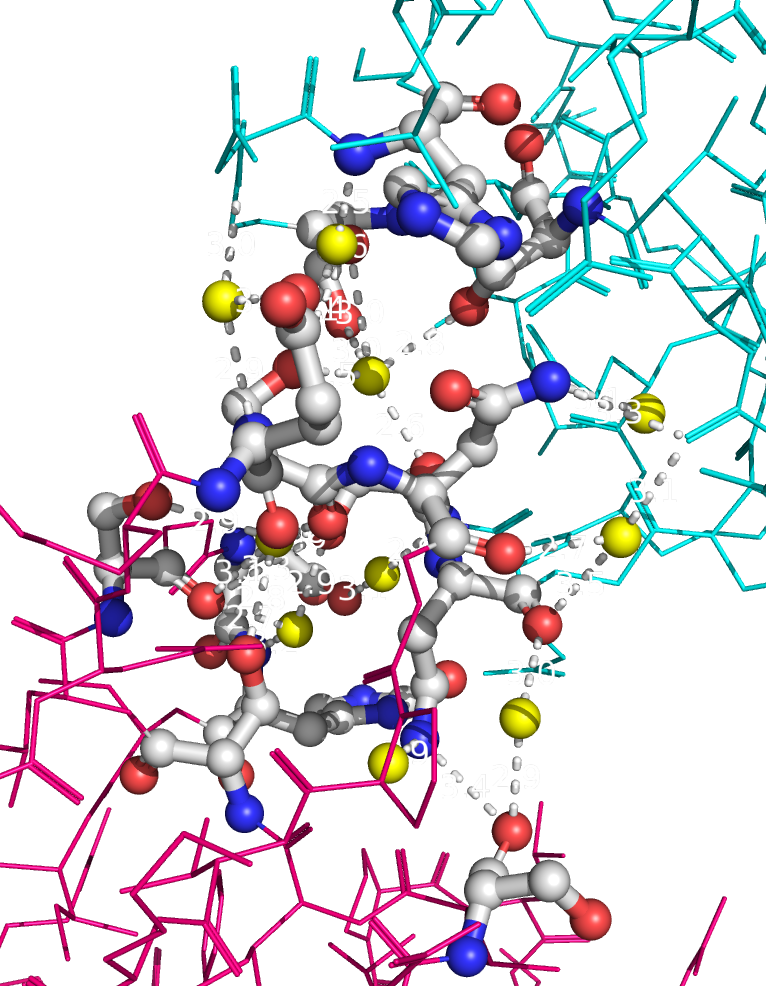
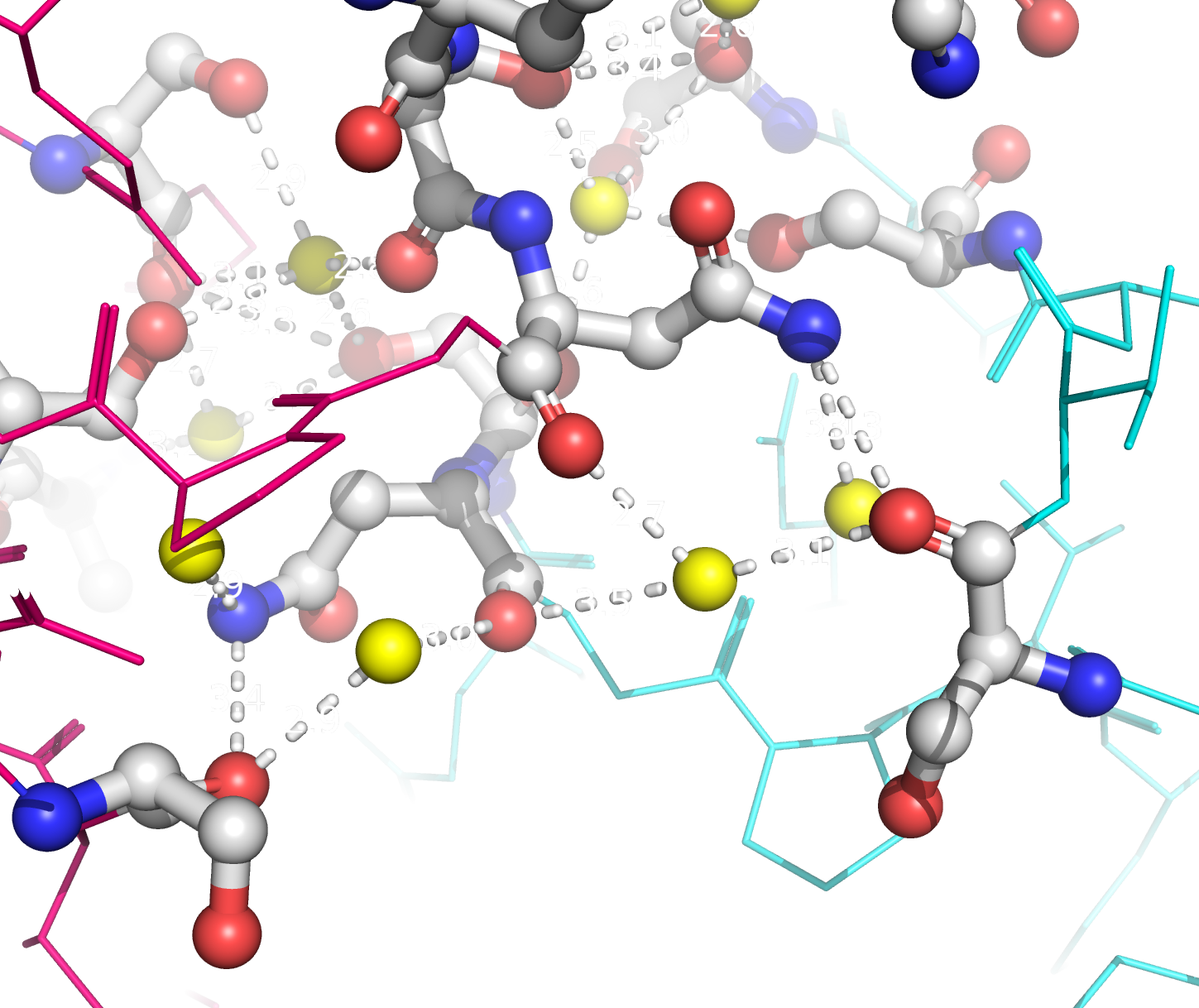
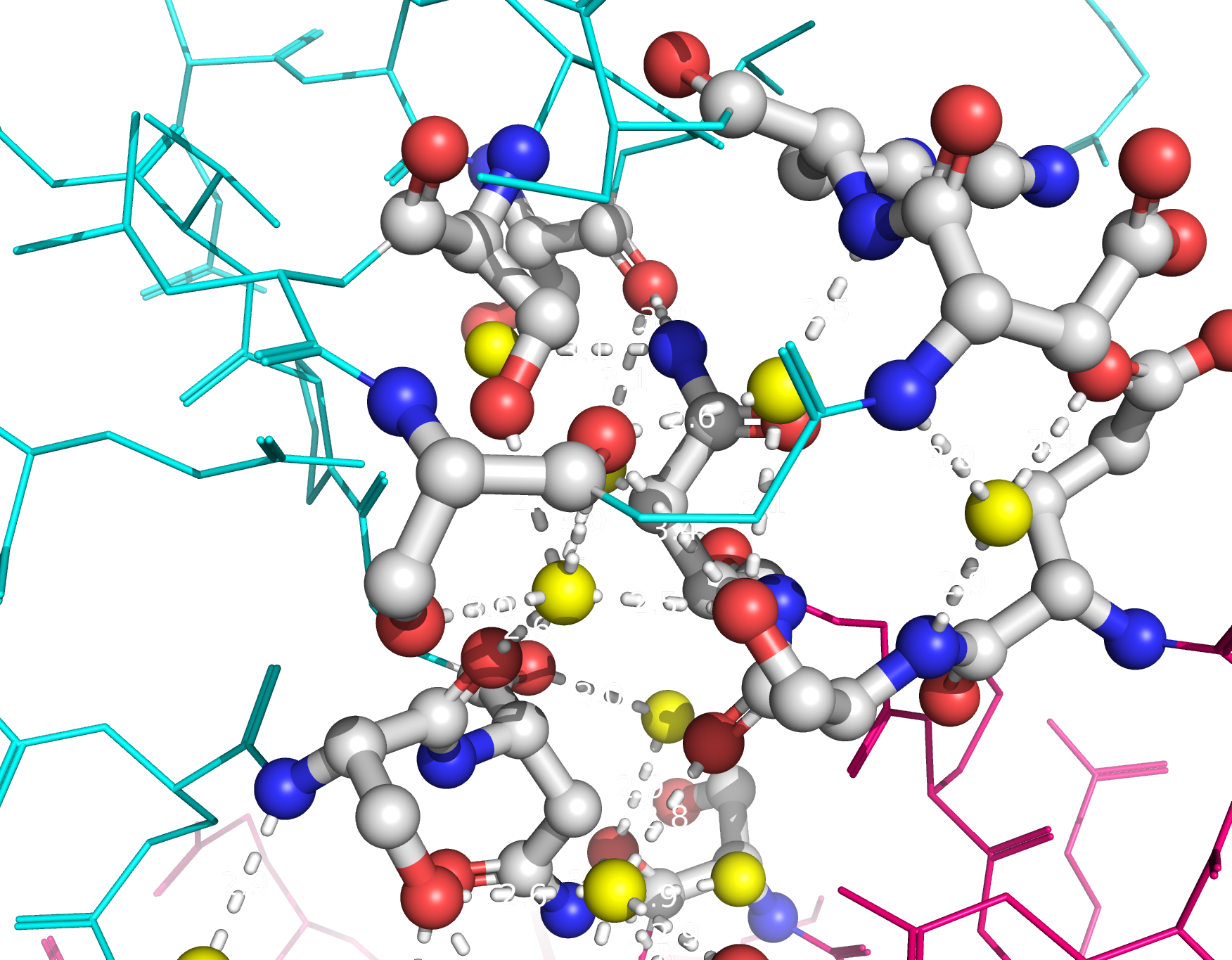
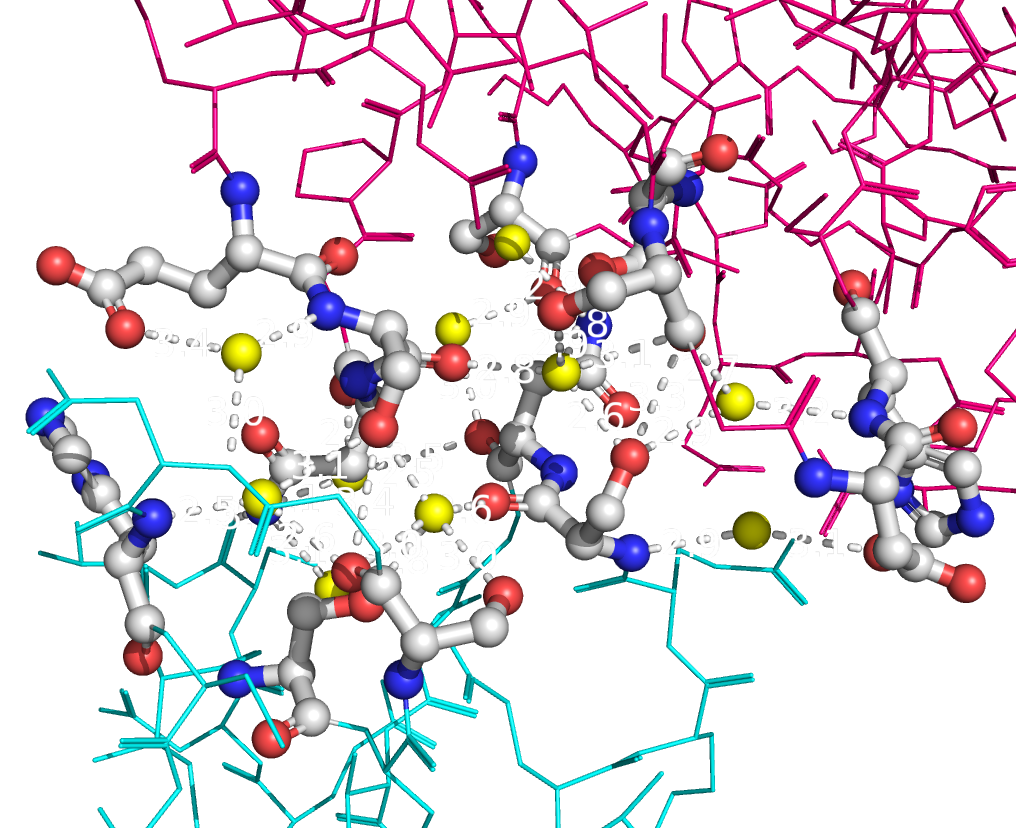
Рисунок 9b. Полярные контакты между розовой и синей субъединицами. Контакты второго типа представлены на рисунке 10. В образовании контактов между этими субъединицами участвуют такие остатки, как Lys75, Asp76, Asn86, Thr88, Asp96, Ser98, Asp125, Lys128, Asn131, Glu132, Thr135. Эти остатки совпадают с теми, которые формируют контакты между димерами. Таким образом, такие контакты могут принимать участие в олигомеризации Cu,Zn-СОД. 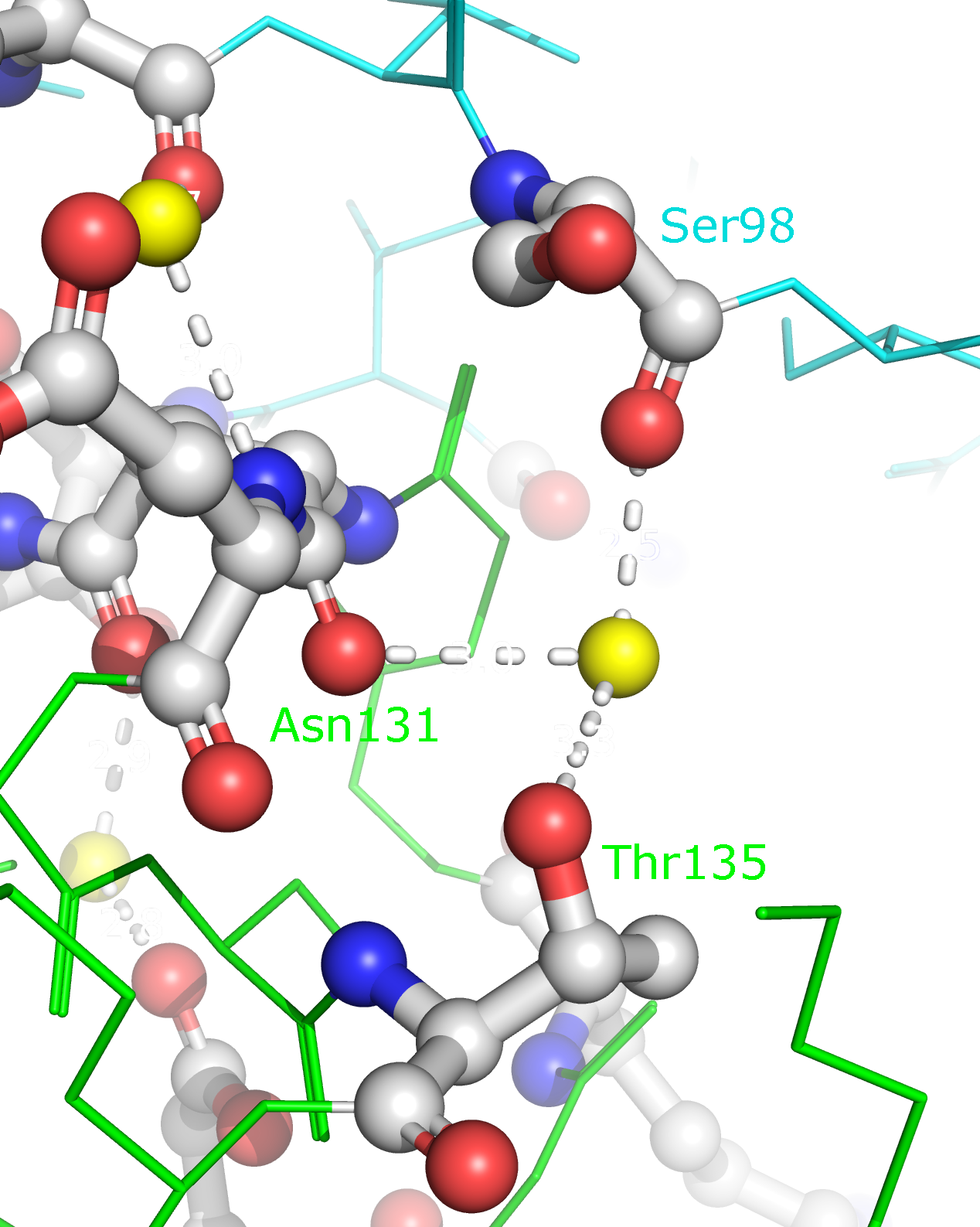
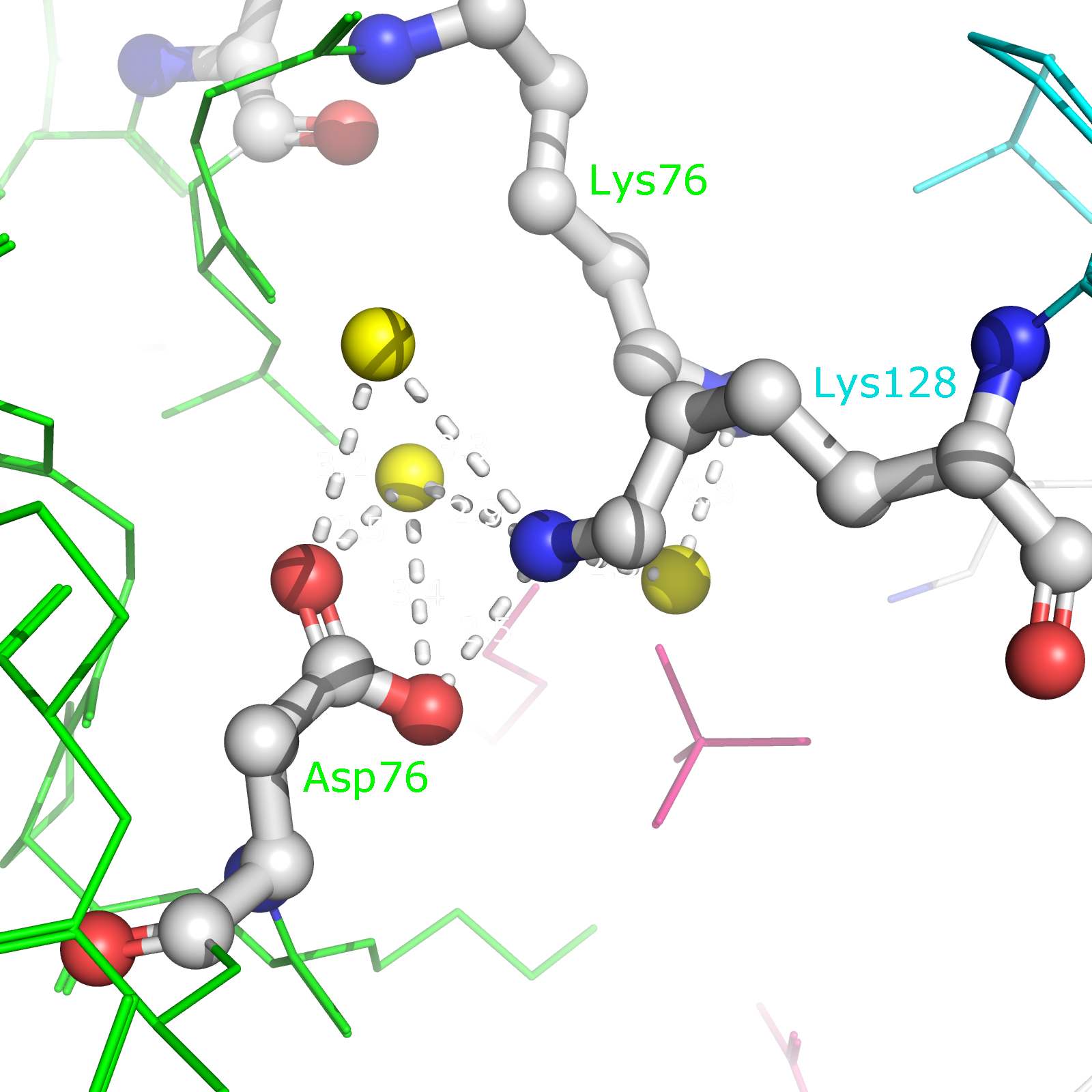
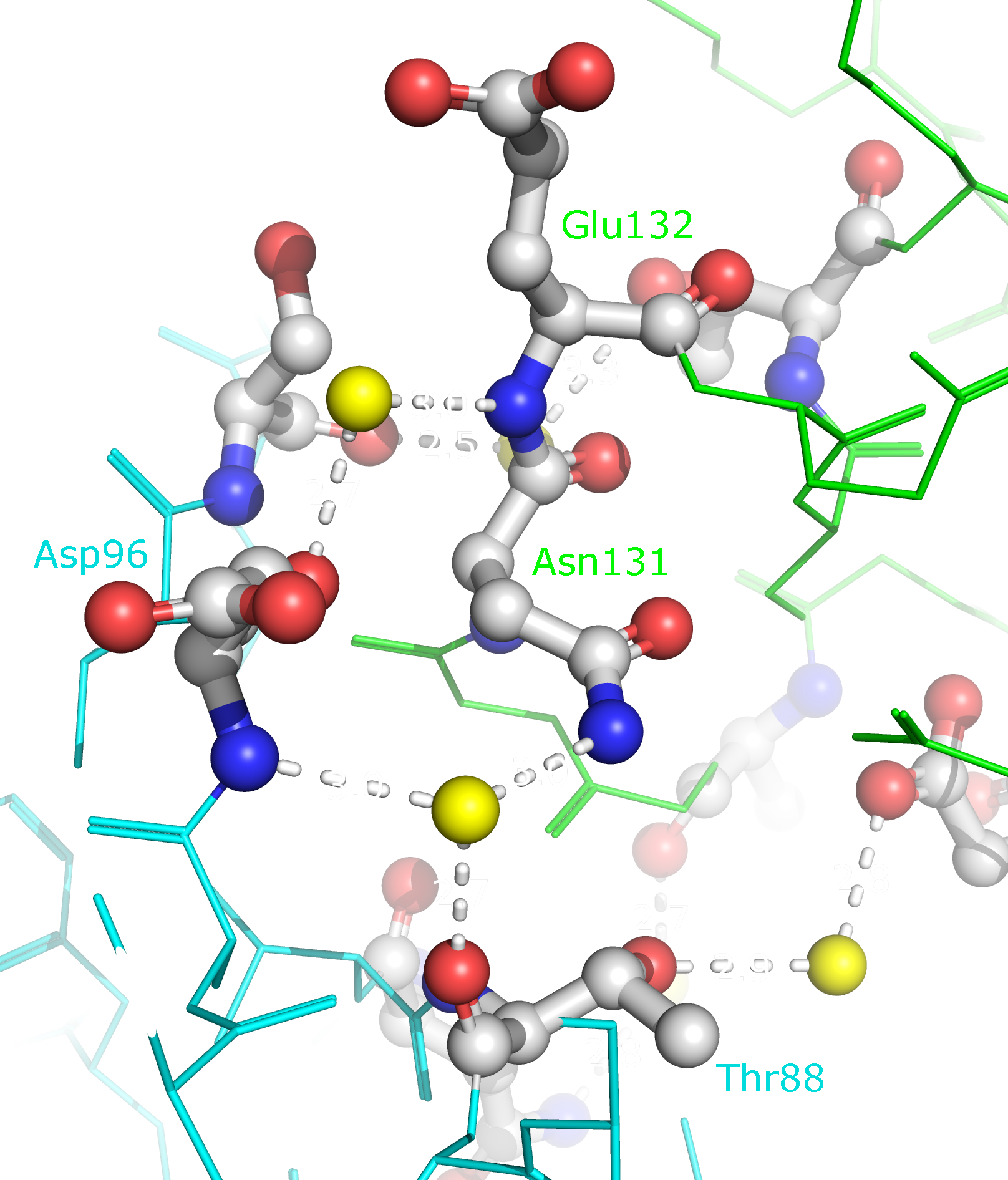
Рисунок 10a. Полярные контакты между синей и зеленой субъединицами. Водородные связи отмечены белыми пунктирными линиями, атомы воды - желтыми шариками. Взаимодействующие аминокислоты отмечены и покрашены по стандартной цветовой схеме PyMol по типу атома (C - серый, N - синий, O - красный). Номера остатков, принимающих участие в образовании водородных связей, подписаны и обозначены цветом, соответствующим цвету белковой цепи. 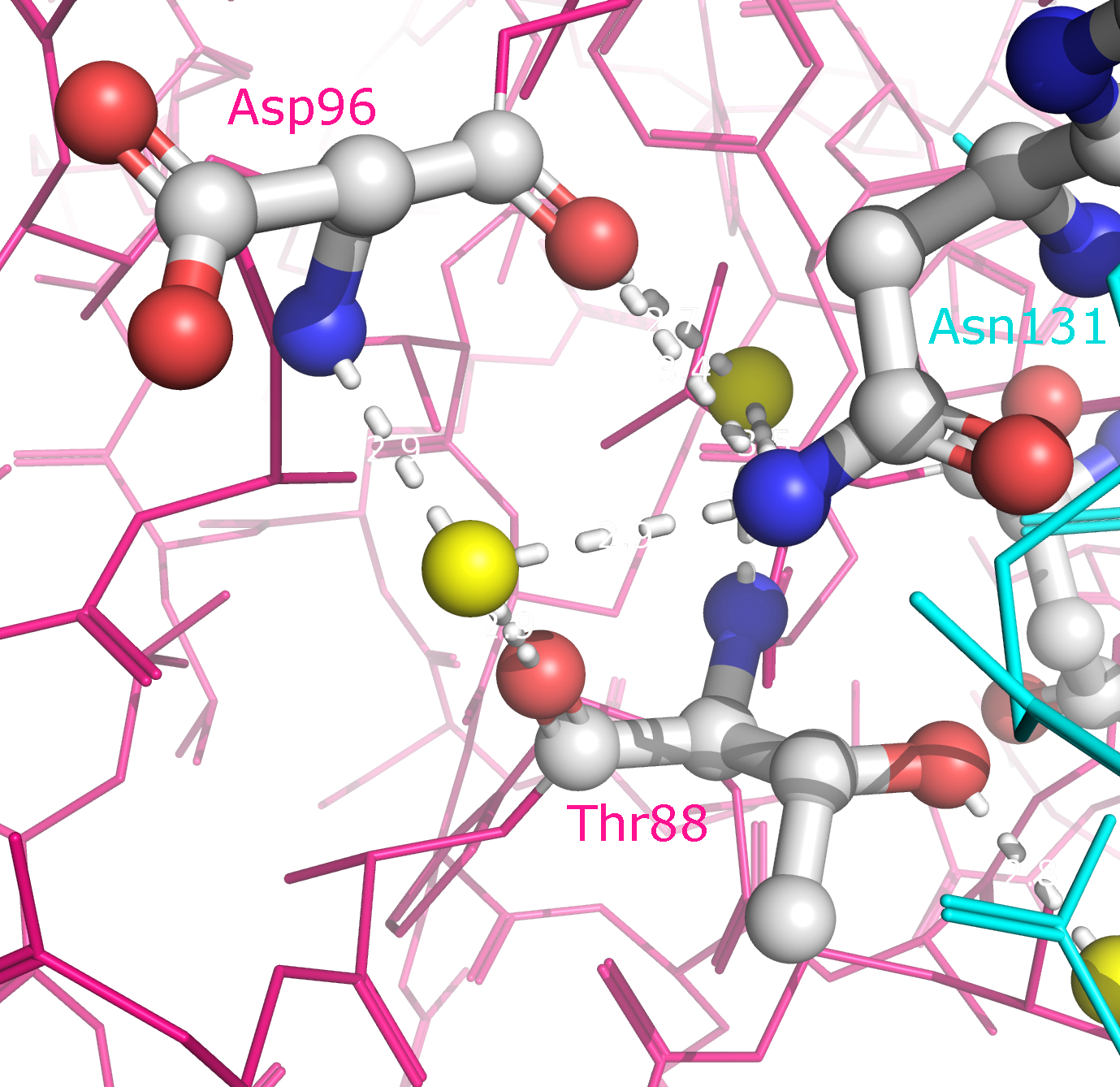
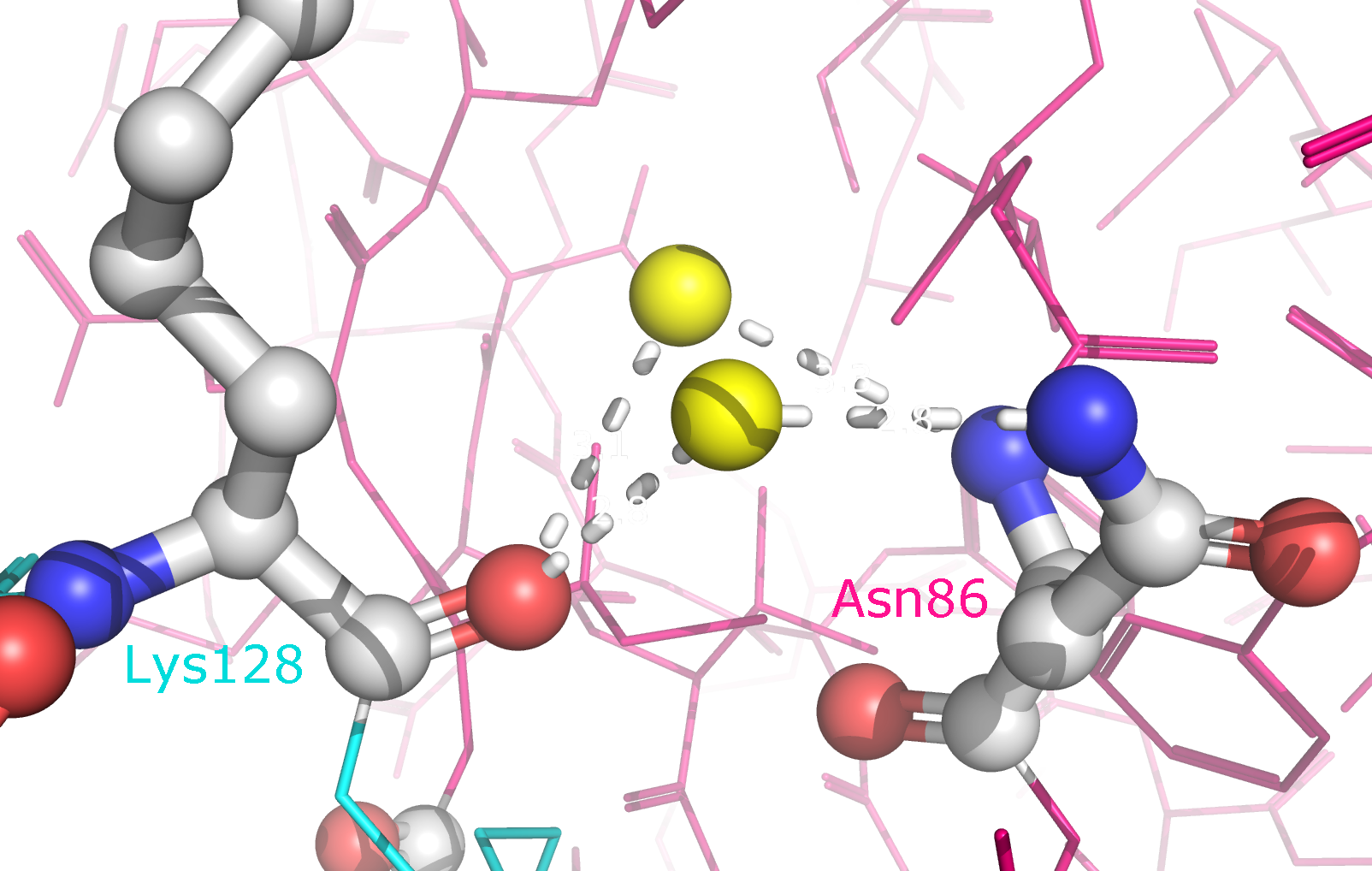
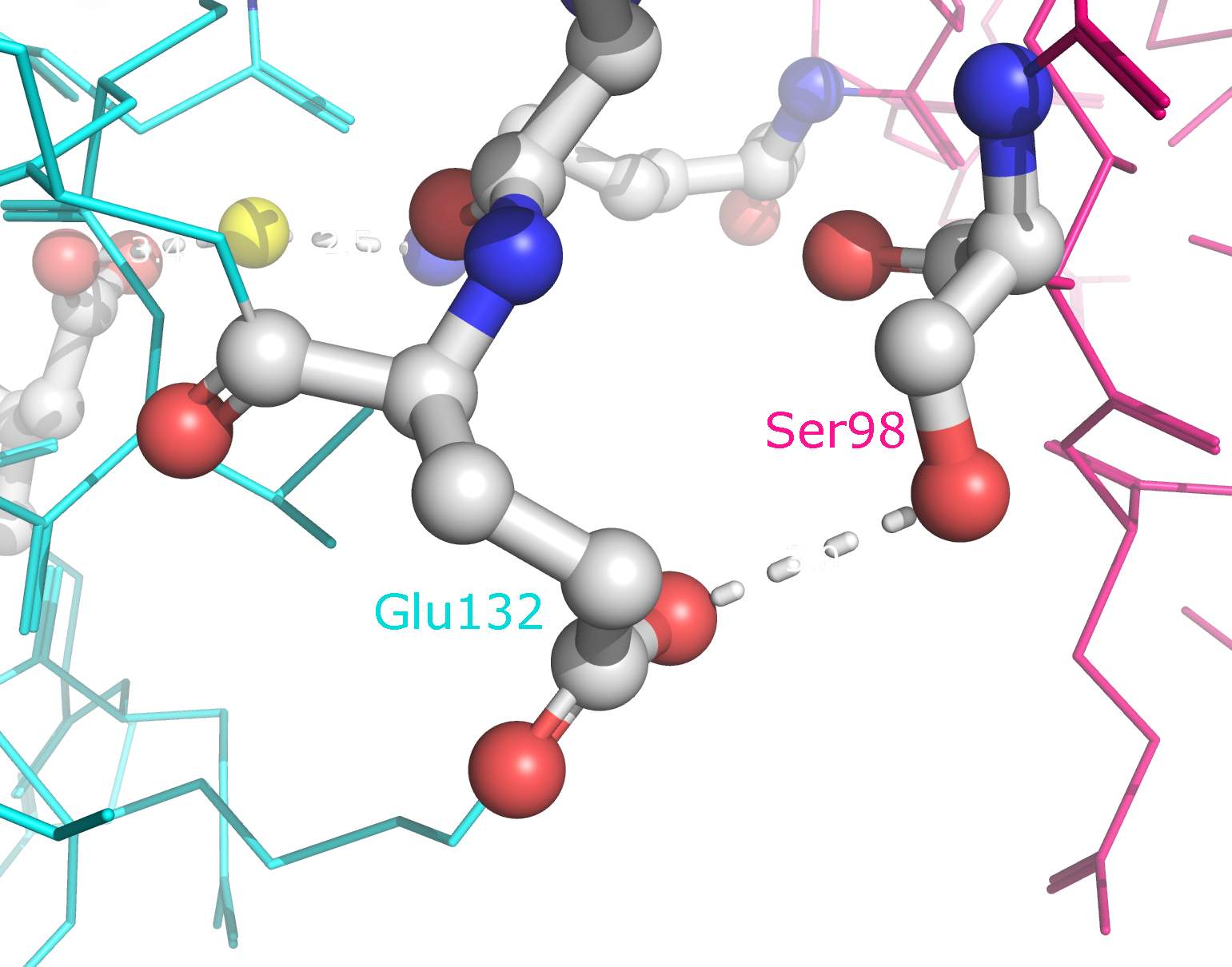
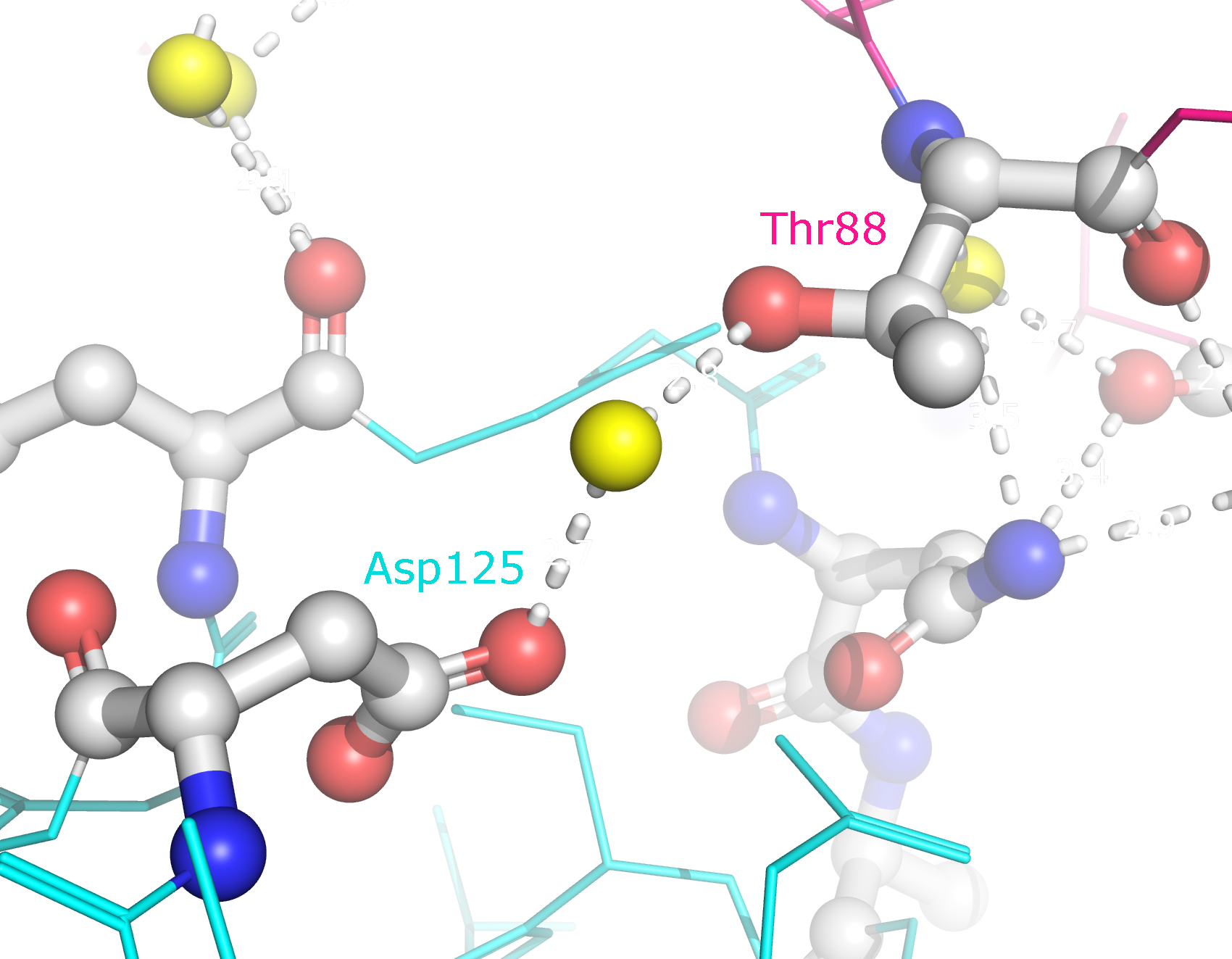
Рисунок 10b. Полярные контакты между синей и розовой субъединицами. Странное расположение белковых цепей в структуре ДНК-белкового комплексаВ структуре ДНК-белкового комплекса 1MNM одна из субъединиц белка как будто связывается на краю ДНК, а у бета-слоя изображена только одна цепь (рисунок 11). 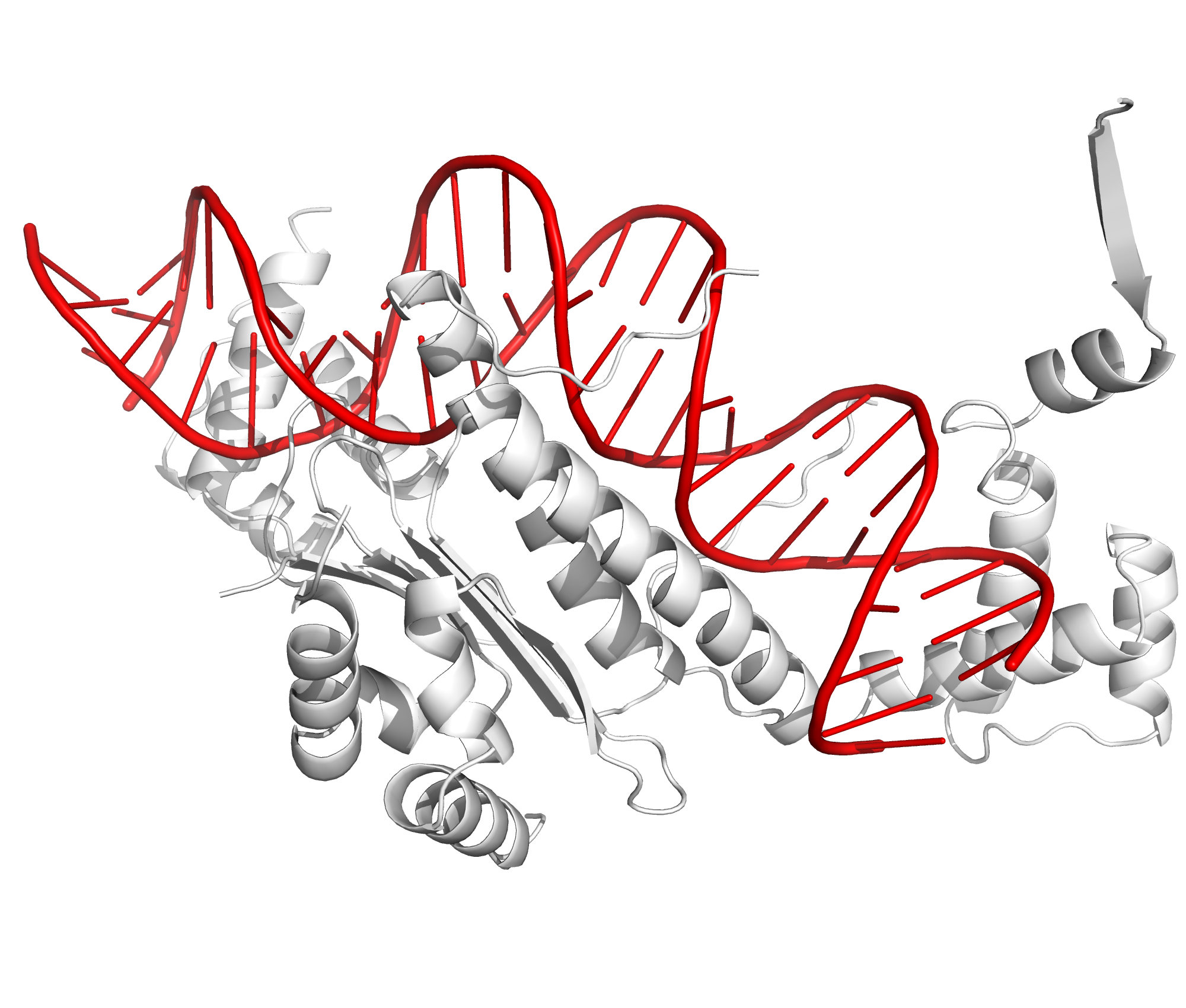
Рисунок 11. Структура ДНК-белкового комплекса 1MNM. ДНК отмечена красным, белок - белым. Однако если изобразить соседние молекулы в ячейке кристалла, то все странности исчезают: бета-слой образуется за счет контакта между двумя субъединицами белка, а те субъединицы белка, которые словно висят в пространстве при изображении асимметрической ячейки на самом деле связываются с ДНК из соседней ячейки (рисунок 12). 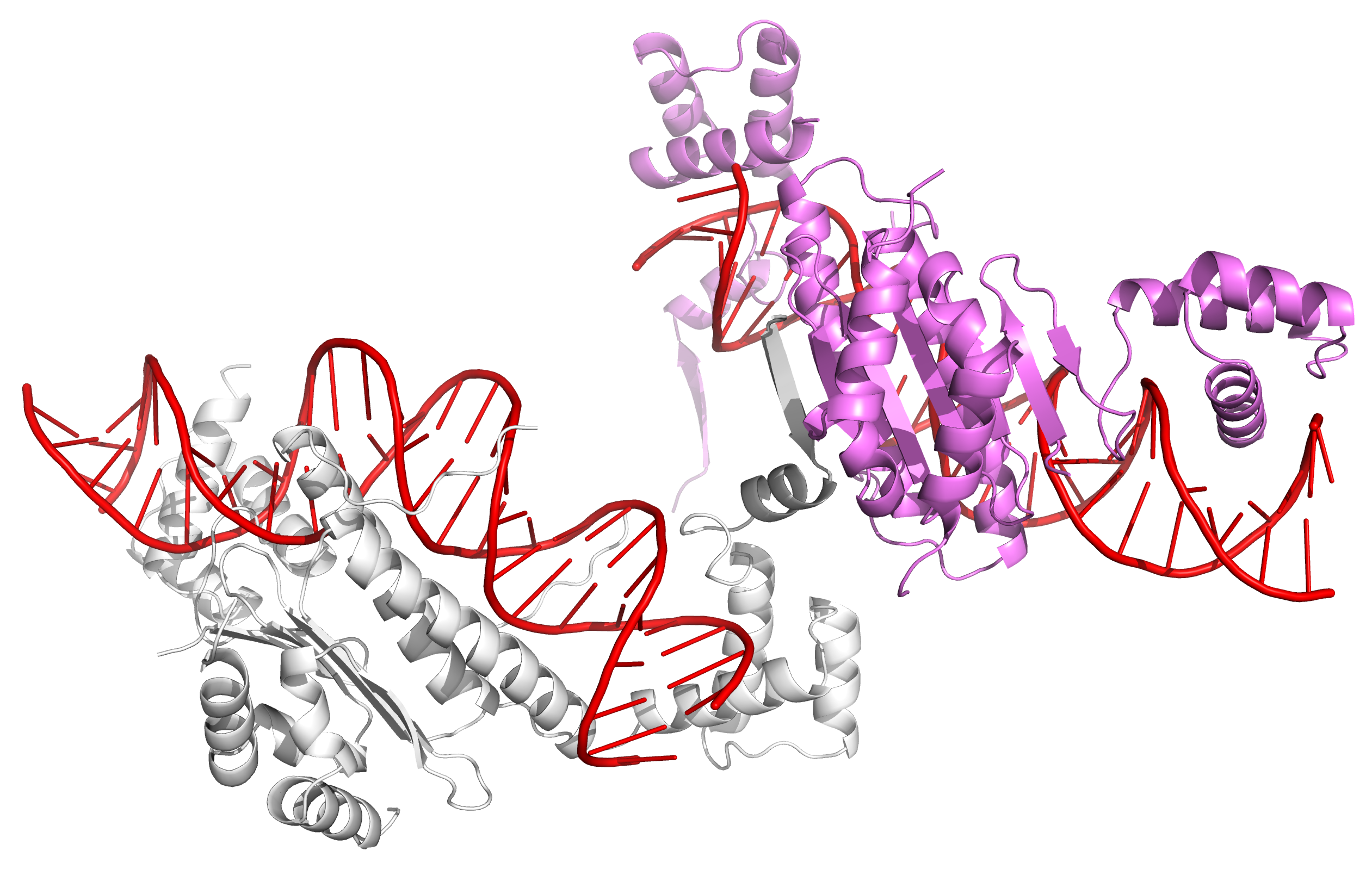
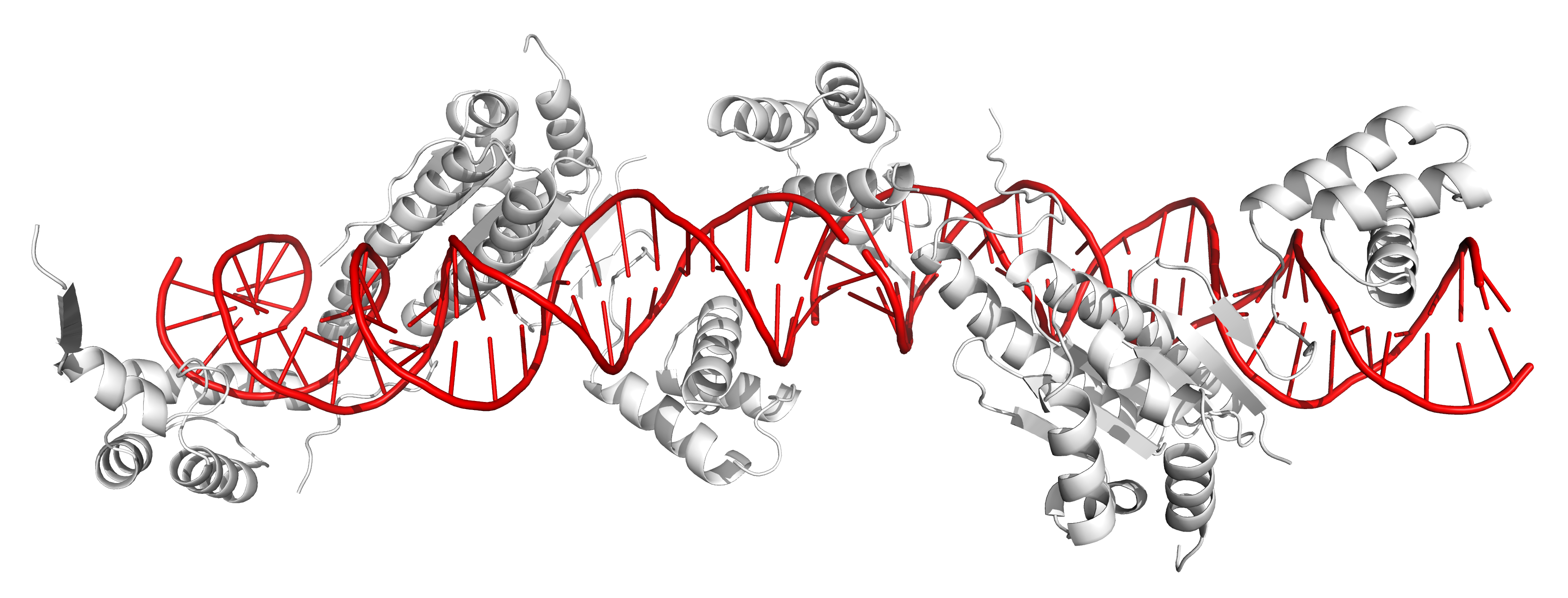
Рисунок 12. Соседние асимметрические ячейки в кристалле ДНК-белкового комплекса 1MNM. ДНК отмечена красным, субъединицы белка из разных асимметрических ячеек - белым и розовым. В месте образования бета-слоя между субъединицами белка действительно есть контакты (рисунок 13a). Эти контакты в основном представлены водородными связями между остовами полипептидных цепей, однако встречаются и водородные связи, образованные радикалами аминокислотных остатков. На рисунках 13b и 13c представлены контакты между субъединицей белка, висящей в пространстве, и молекулой ДНК из соседней ячейки (рисунок 13b), а также ДНК-белковые контакты в одной ячейке (рисунок 13c). Внутри одной ячейки ДНК-белковых контактов в целом больше, однако белок также взаимодействует и с ДНК из соседней ячейки. 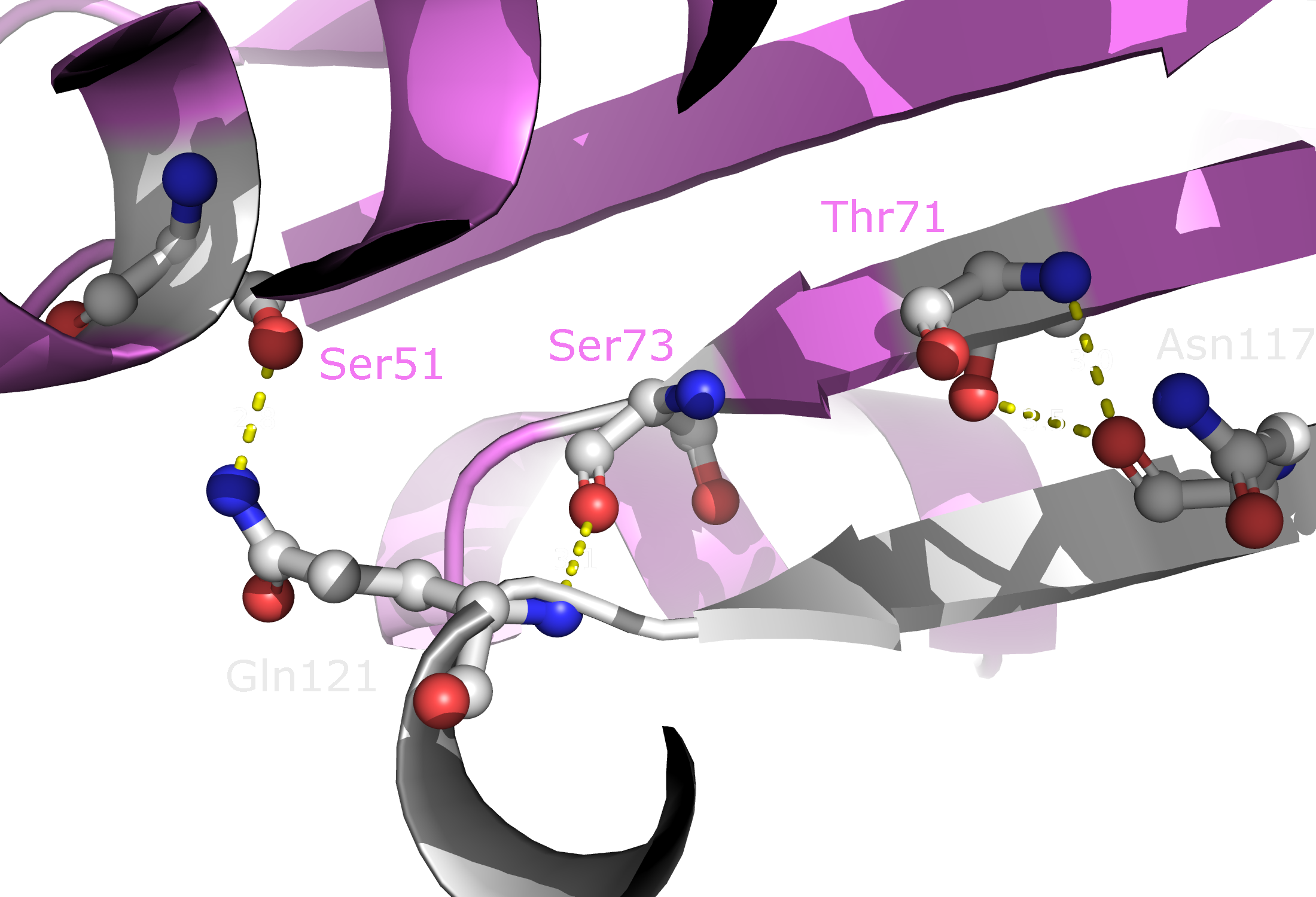
Рисунок 13a. Контакты между двумя субъединицами белка из соседних асимметрических ячеек (отмечены белым и розовым). Аминокислотные остатки, участвующие в образовании водородных связей, выделены и покрашены по стандартной цветовой схеме PyMol по типу атома (C - серый, N - синий, O - красный). Водородные связи (построены с порогом по длине связи не более 3.5 Å) отмечены желтыми пунктирными линиями. Номера остатков обозначены цветом, соответствующим цвету белковой цепи. 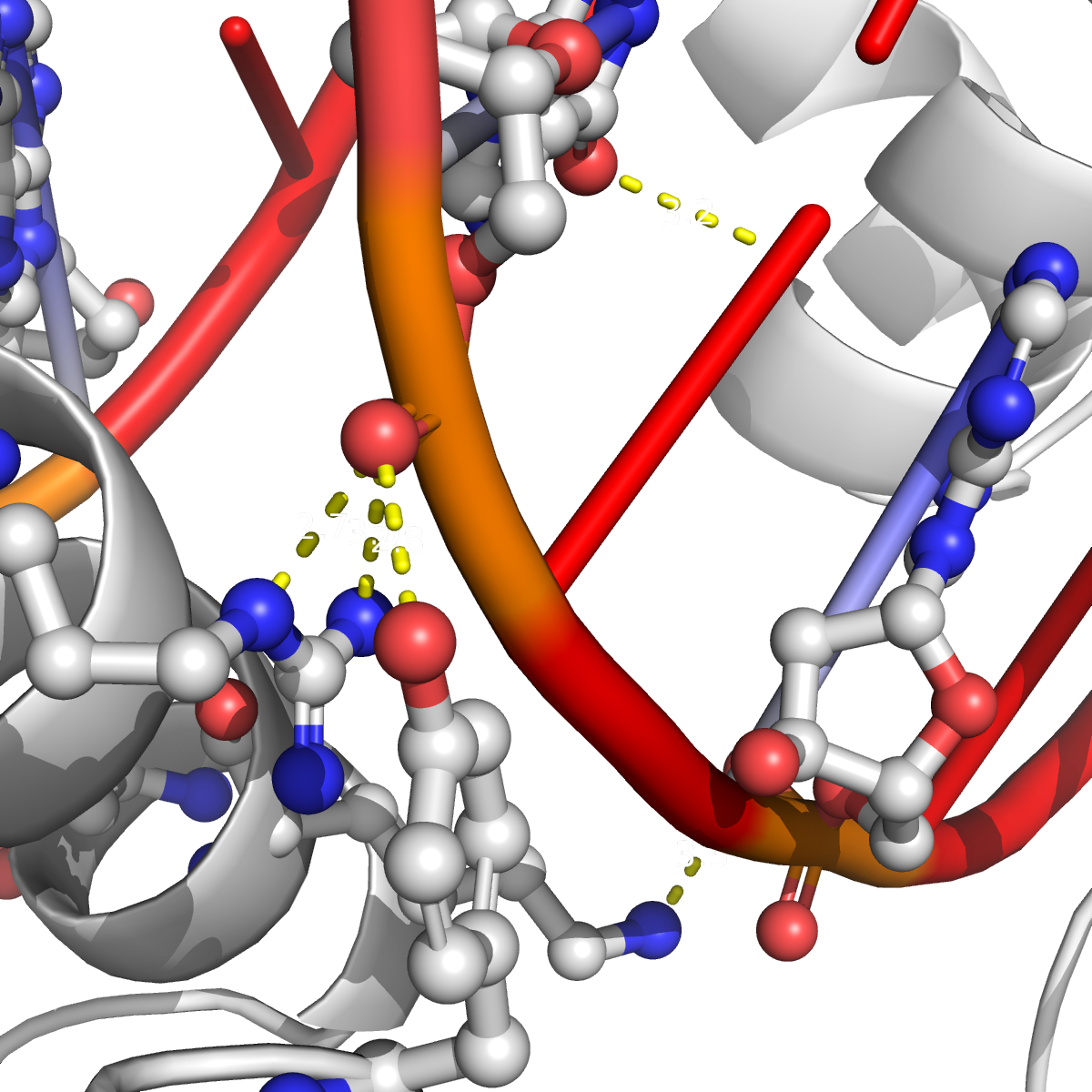
Рисунок 13b. Контакты между белком и ДНК из соседней асимметрической ячейки. 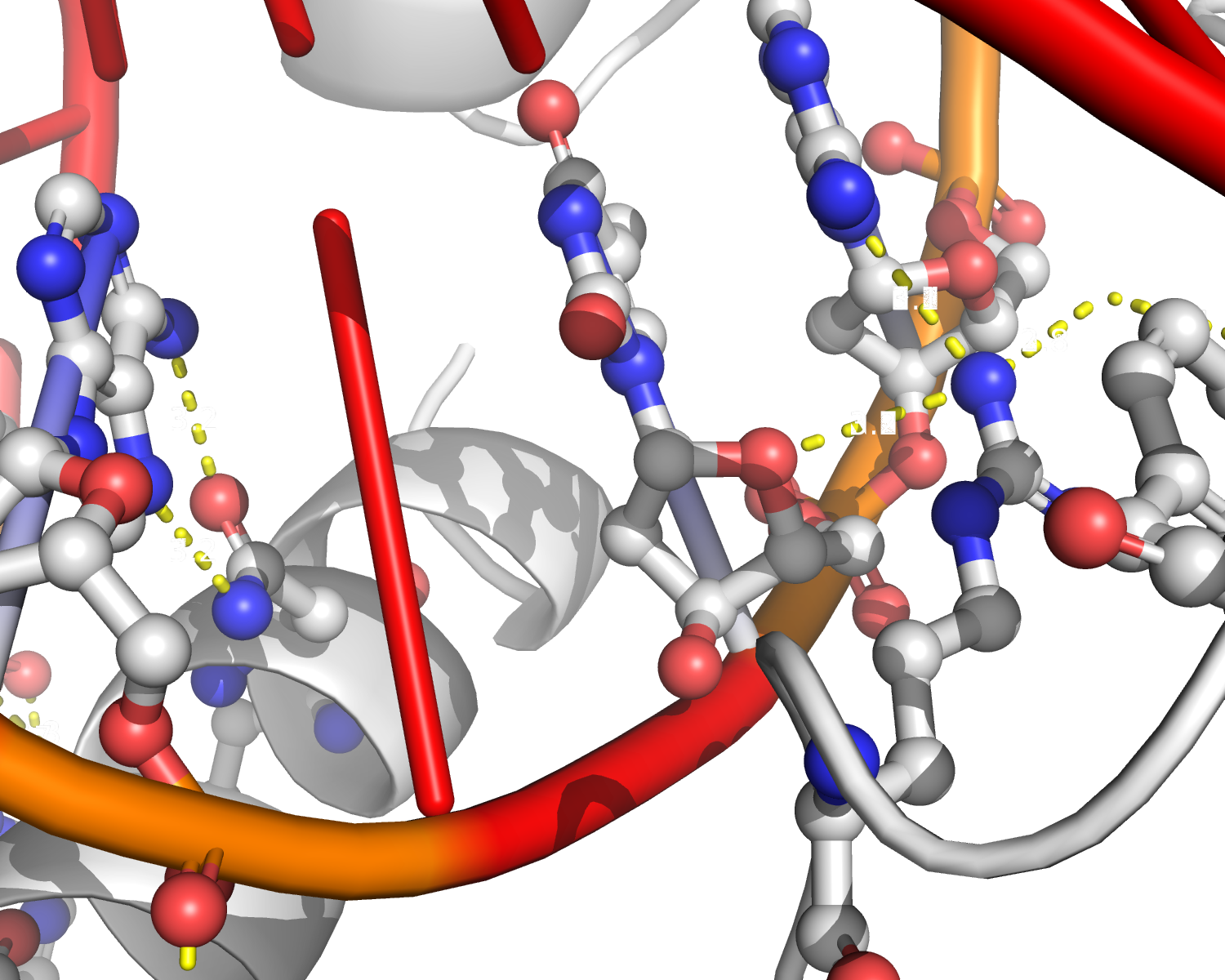
Рисунок 13c. Контакты между белком и ДНК внутри одной асимметрической ячейки. Структуры, в которых асимметрические единицы не совпадают с биологическими единицамиВ самой струкутре Cu,Zn-СОД (1PU0) асимметрическая единица включает в себя 5 биологических единиц, так как Cu,Zn-СОД активна в виде димера (рисунок 14). 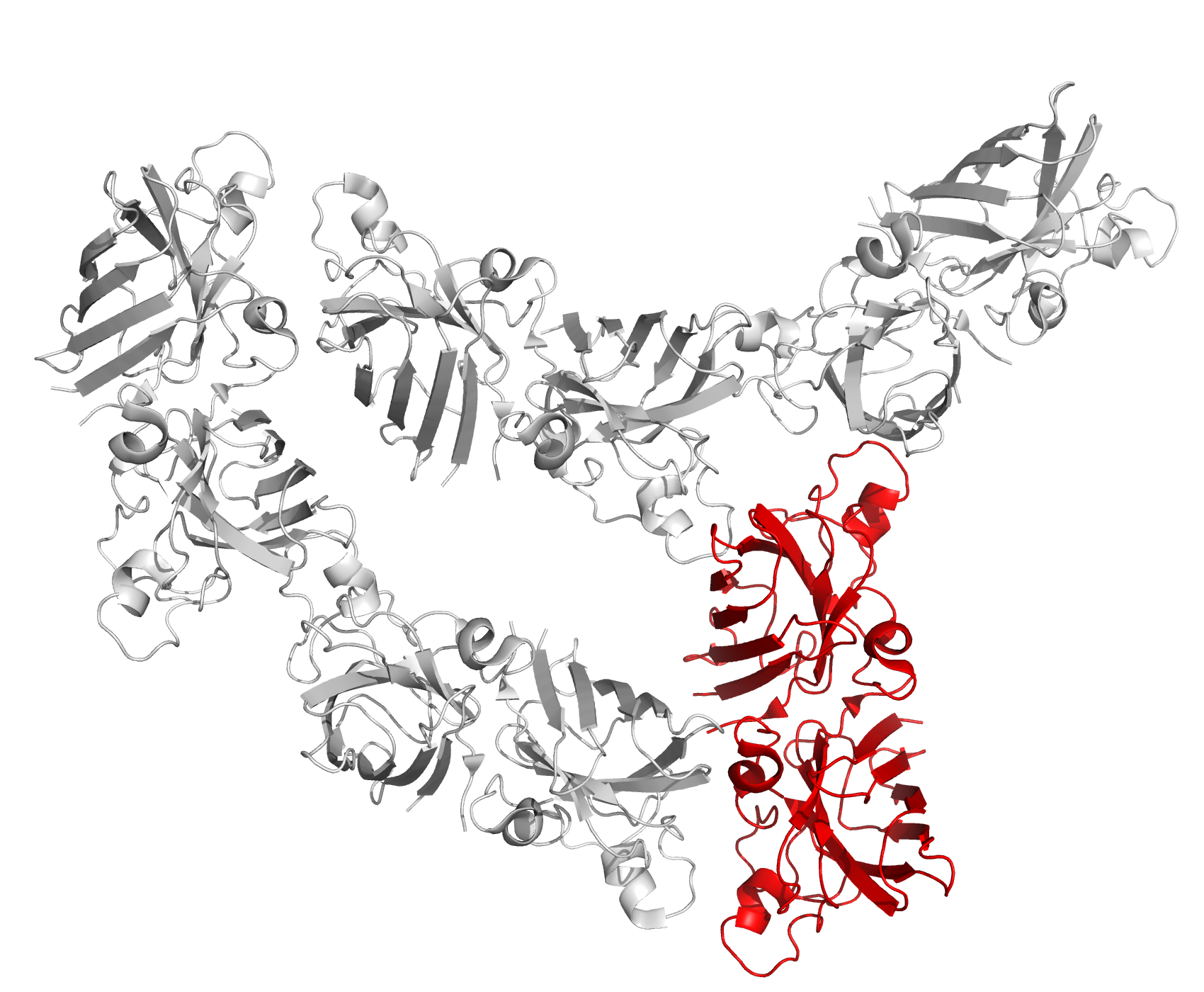
Рисунок 14. Структура 1PU0. Биологическая единица выделена красным. Еще один пример такого же строения файла (когда биологическая единица меньше асимметрической) - 5XEX (рисунок 15).
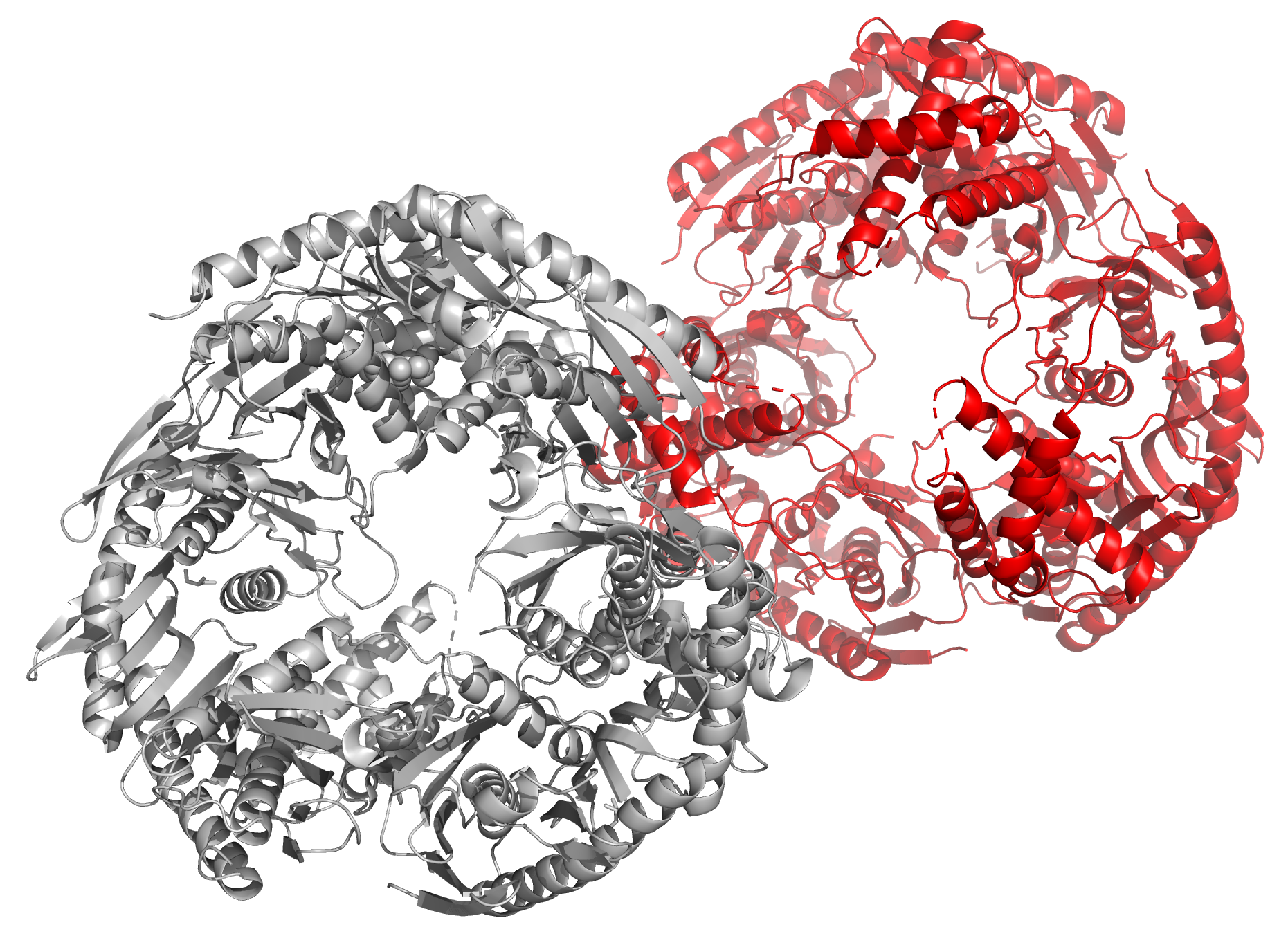
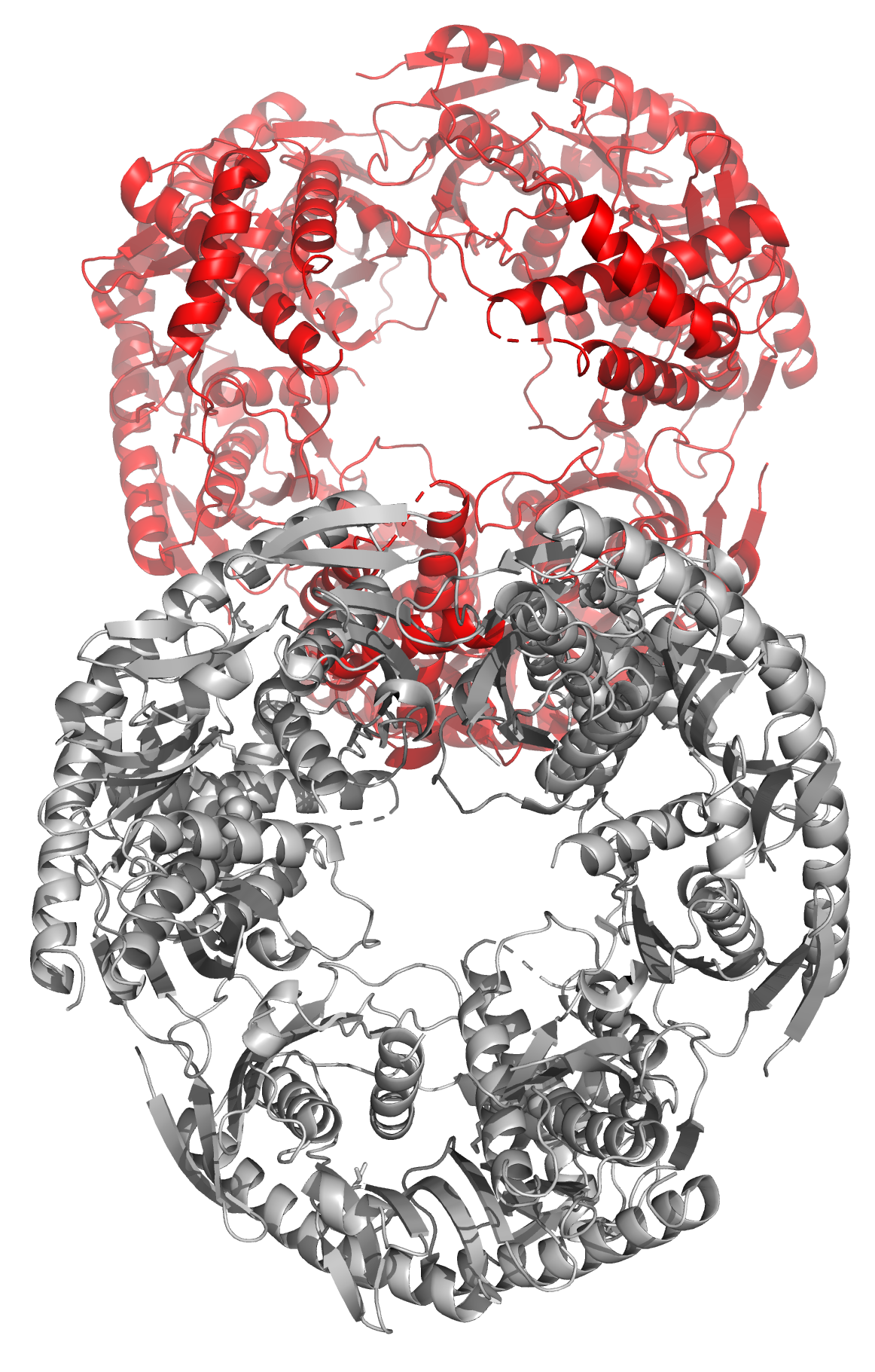
Рисунок 15. Структура 5XEX. Биологическая единица выделена красным. Другой случай - когда биологическая единица состоит их нескольких асимметрических единиц - представлен в PDB-файле 4KD6 (рисунок 16). Обычно такое являение возникает, если биологическая единица является гомополимером и состоит из 2 и более одинаковых субъединиц, расположенных в соответствии с некоторой симметрией.
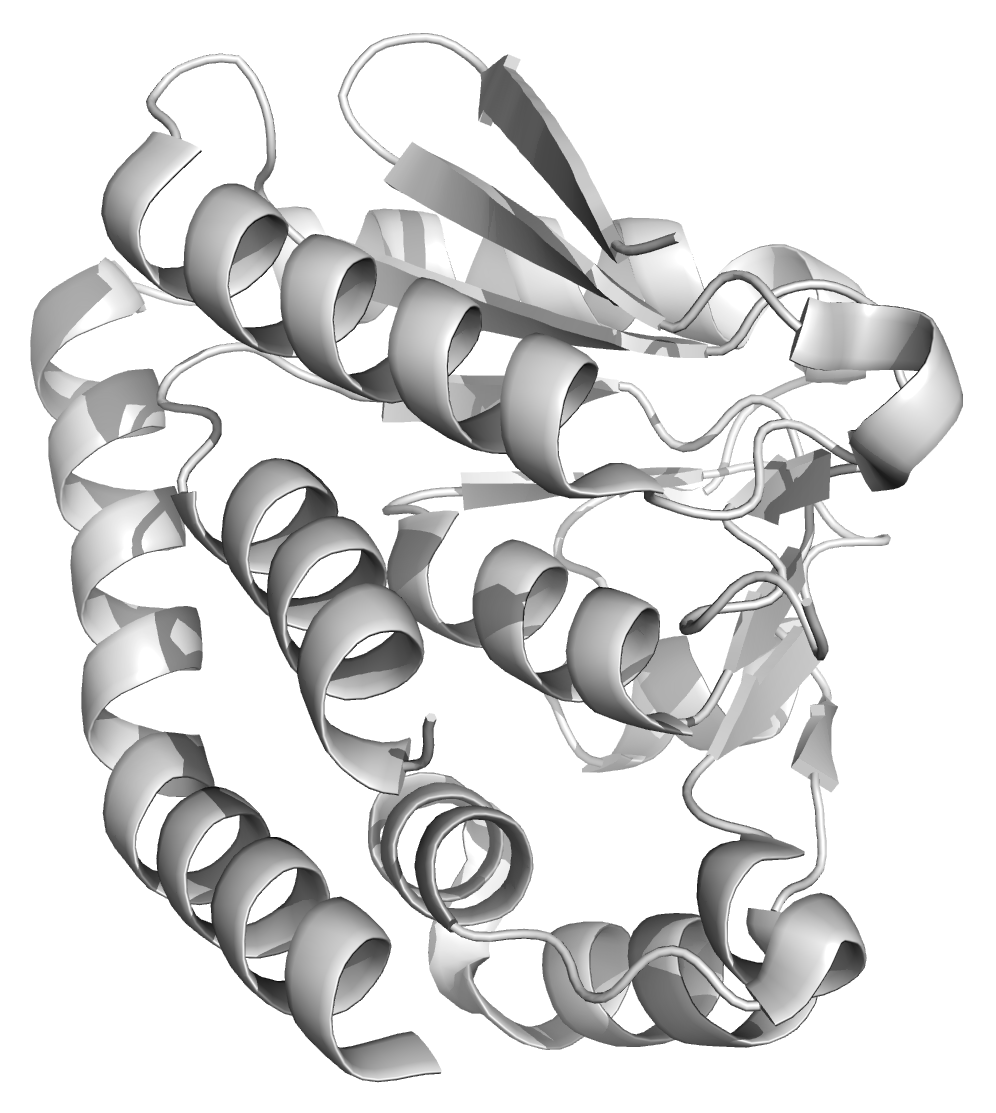
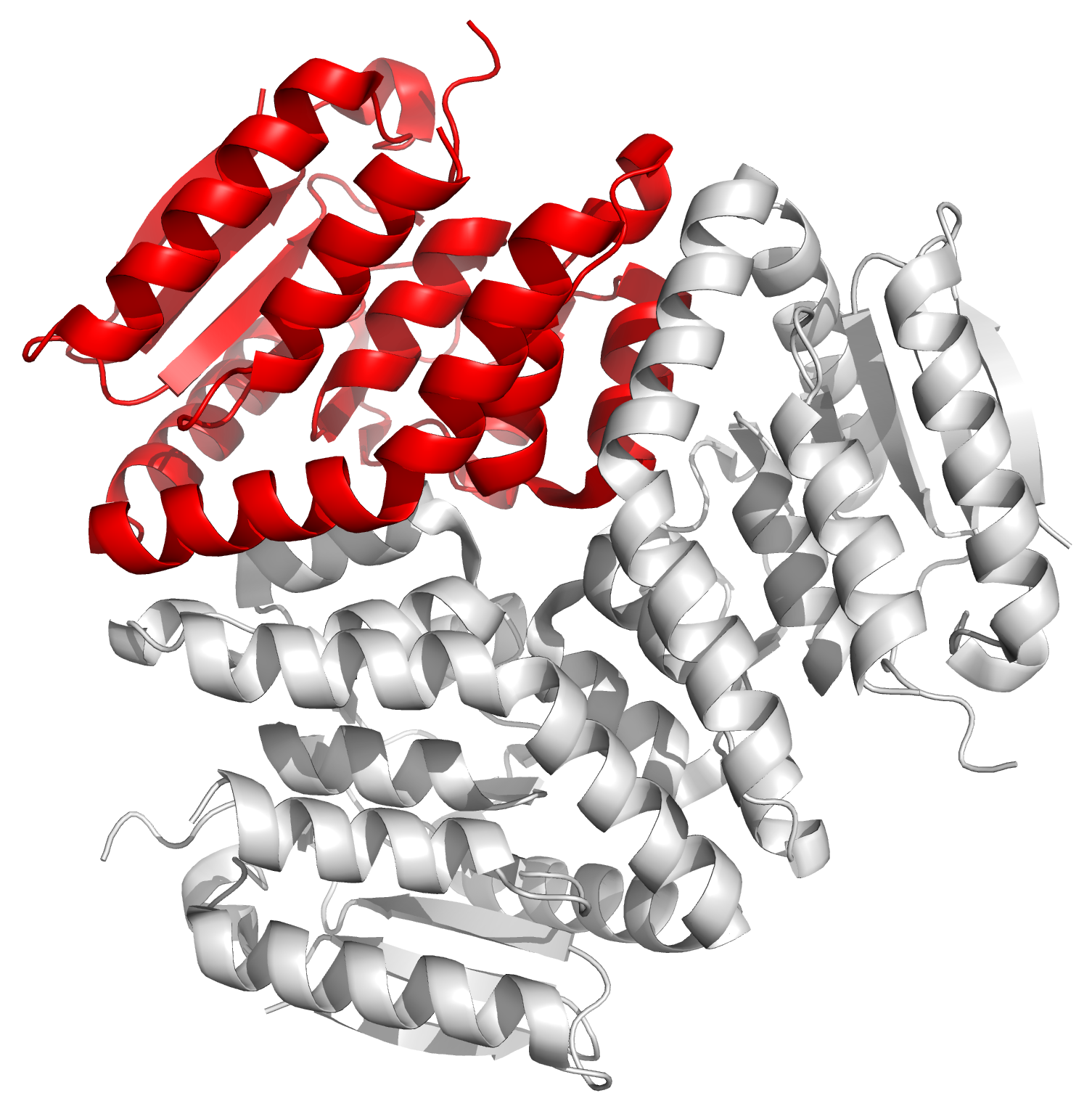
Рисунок 16. Структура 4KD6. Три асимметрические единицы (сверху) образуют одну биологическую единицу (снизу). На изображении снизу одна асимметрическая единица выделена красным. |
|
© Наталия Кашко, 2017 |