|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
В этом практикуме я сравнивала структуры Cu,Zn-супероксиддисмутазы человека, полученные методами ЯМР
(1BA9, рисунок 1) и РСА
(1PU0). В ЯМР-структуре
содержится 36 моделей (по какой-то причине 6 из них полностью совпадают, поэтому я работала только с 30 моделями).
Разрешение РСА-модели - 1.7 Å.

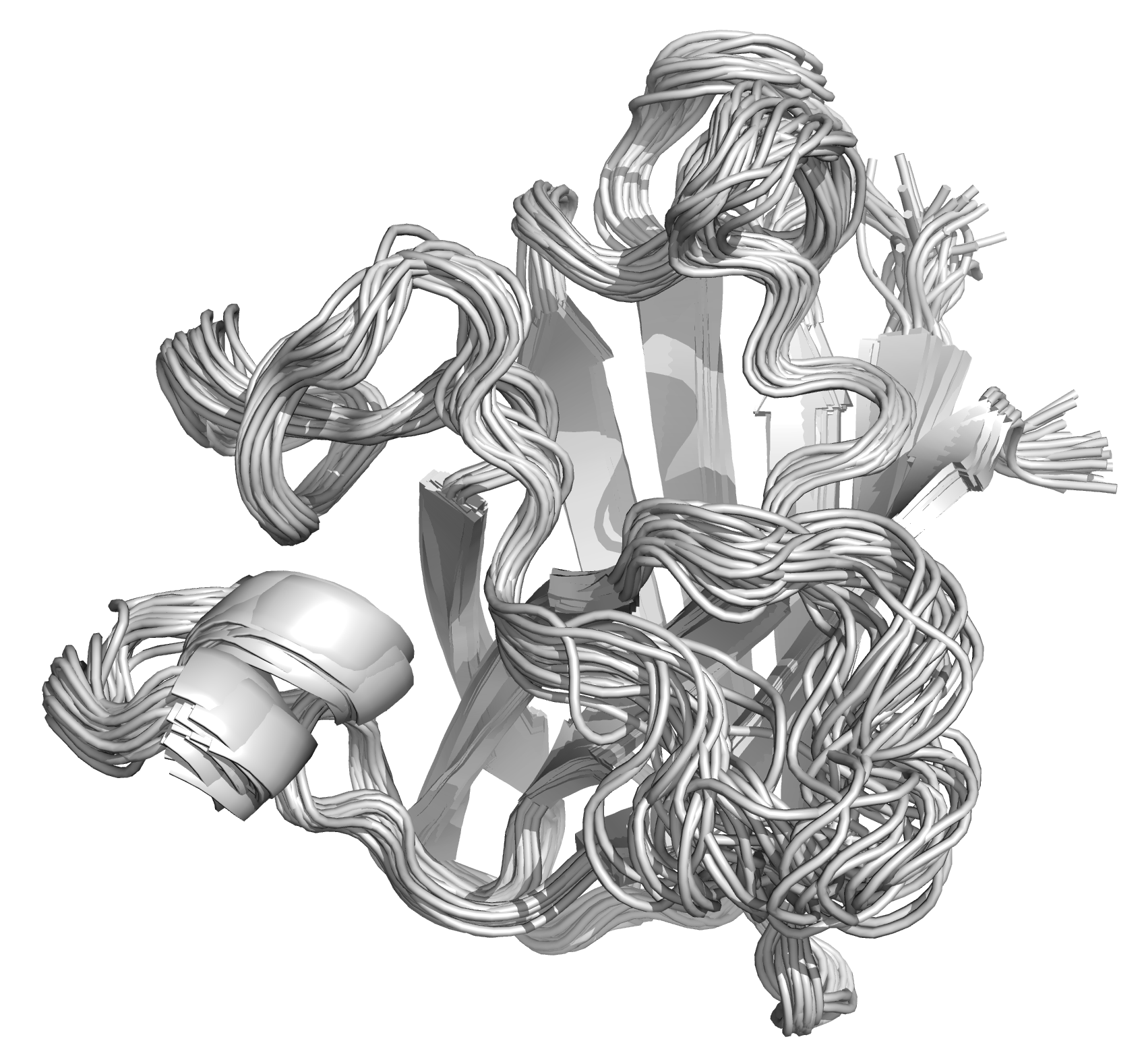
Рисунок 1. ЯМР-структура 1BA9 с разных сторон. Изображены все модели. 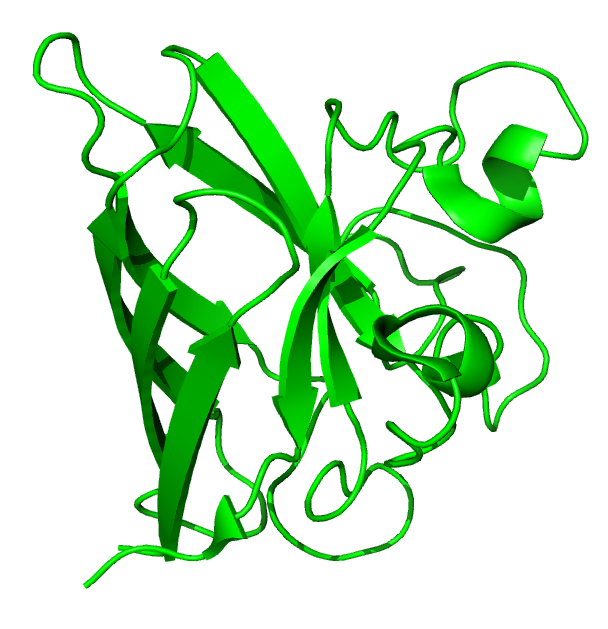
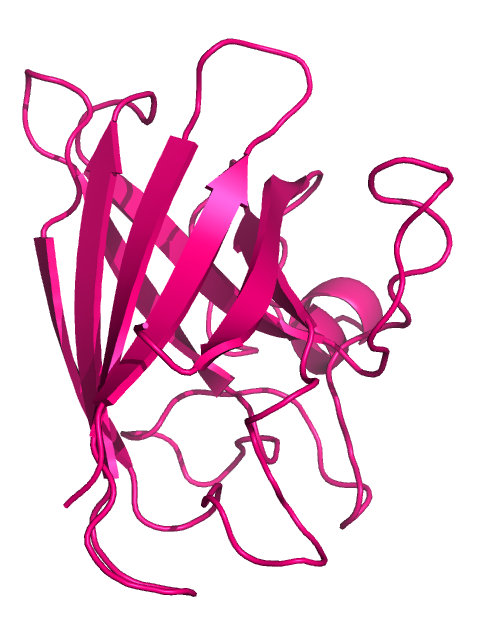
Рисунок 2. Структура Cu,Zn-СОД, расшифрованная методом РСА (1PU0, слева) или ЯМР (1BA9, справа).
Для сравнения этих структур было выбрано несколько аминокислотных остатков, между которыми образуются водородные
связи.
Стоит отметить, что найти водородные связи между боковыми цепями аминокислот внутри глобулы оказалось достаточно сложно, поэтому выбранные остатки расположены не в самой глобуле, а ближе к ее поверхности. 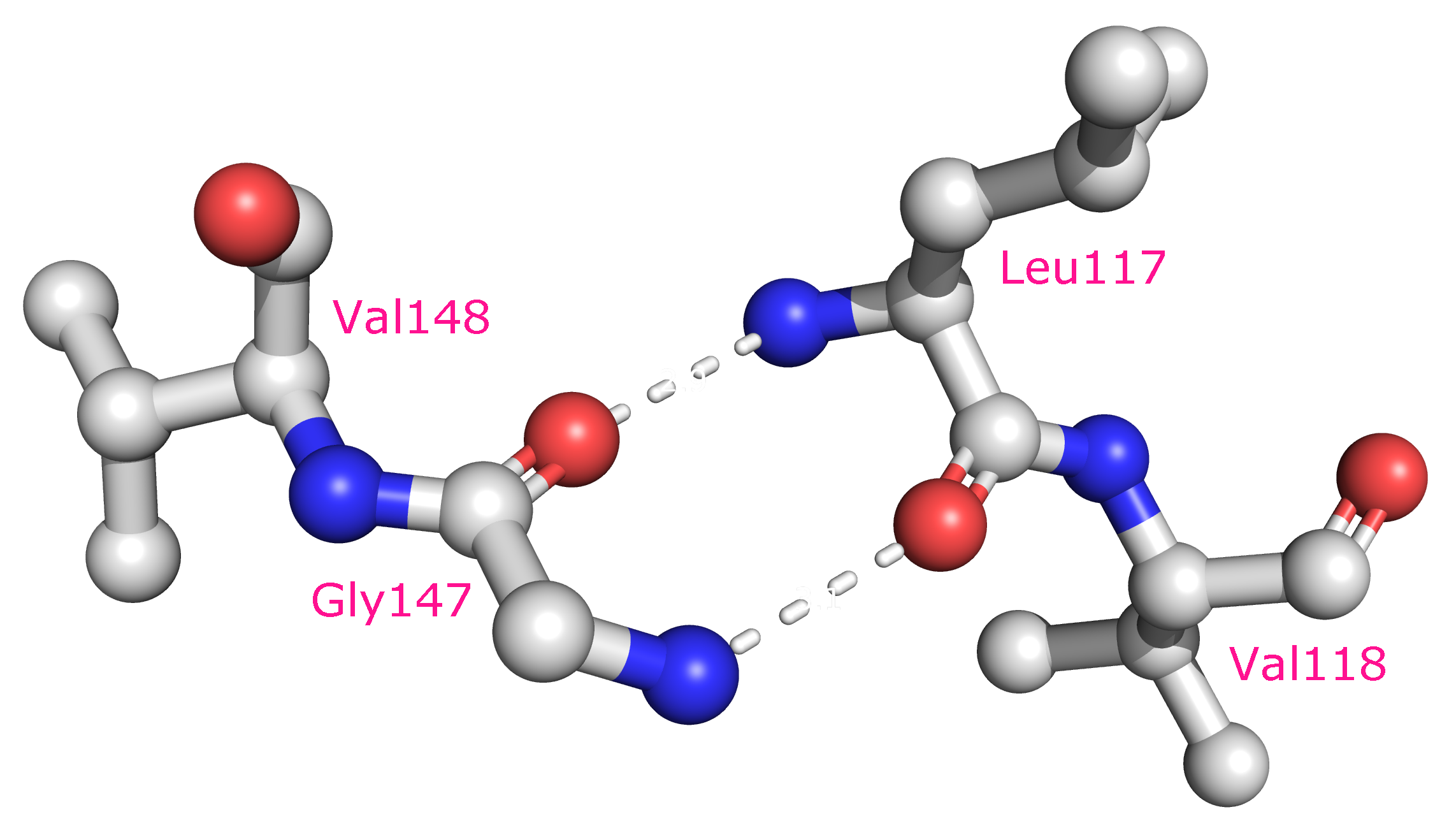
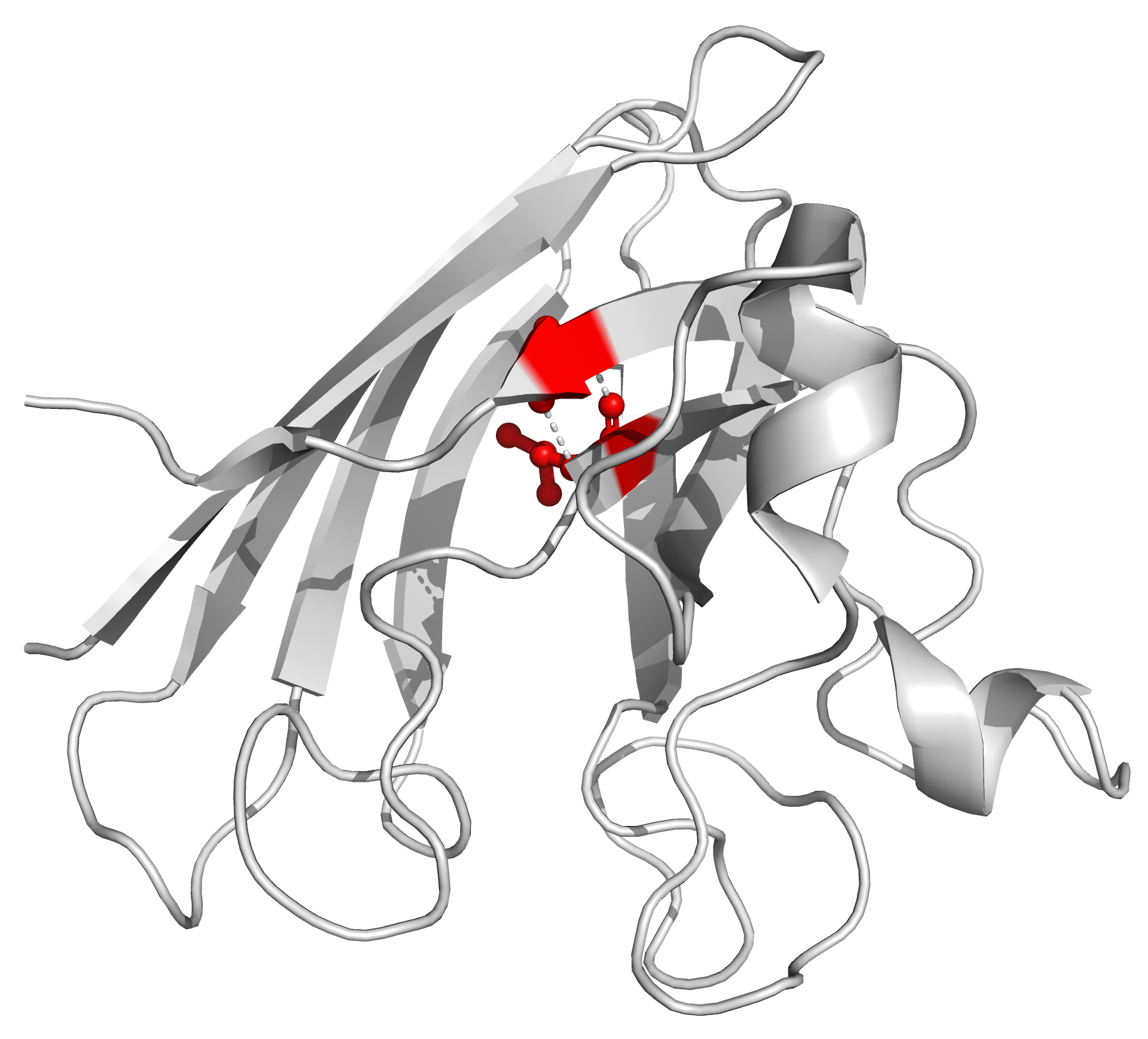
Рисунок 3a. Водородные связи между остовными атомами внутри глобулы белка. Участвующие в контакте аминокислотные остатки - Leu117 и Gly147. Между ними образуются две водородные связи длиной 2.9 и 3.1 Å (слева). Положение остатков (отмечены красным) в структуре белка показано справа. 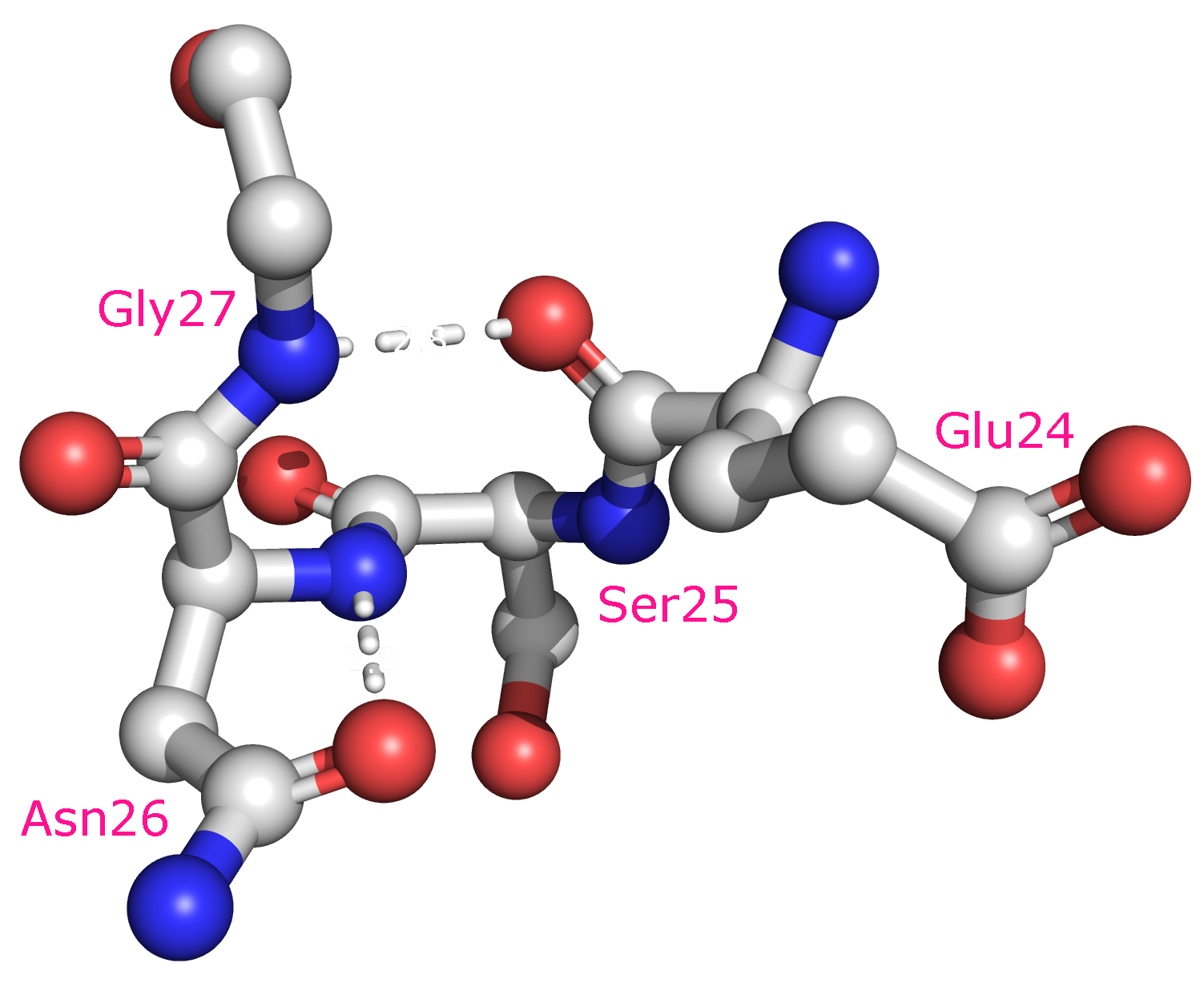
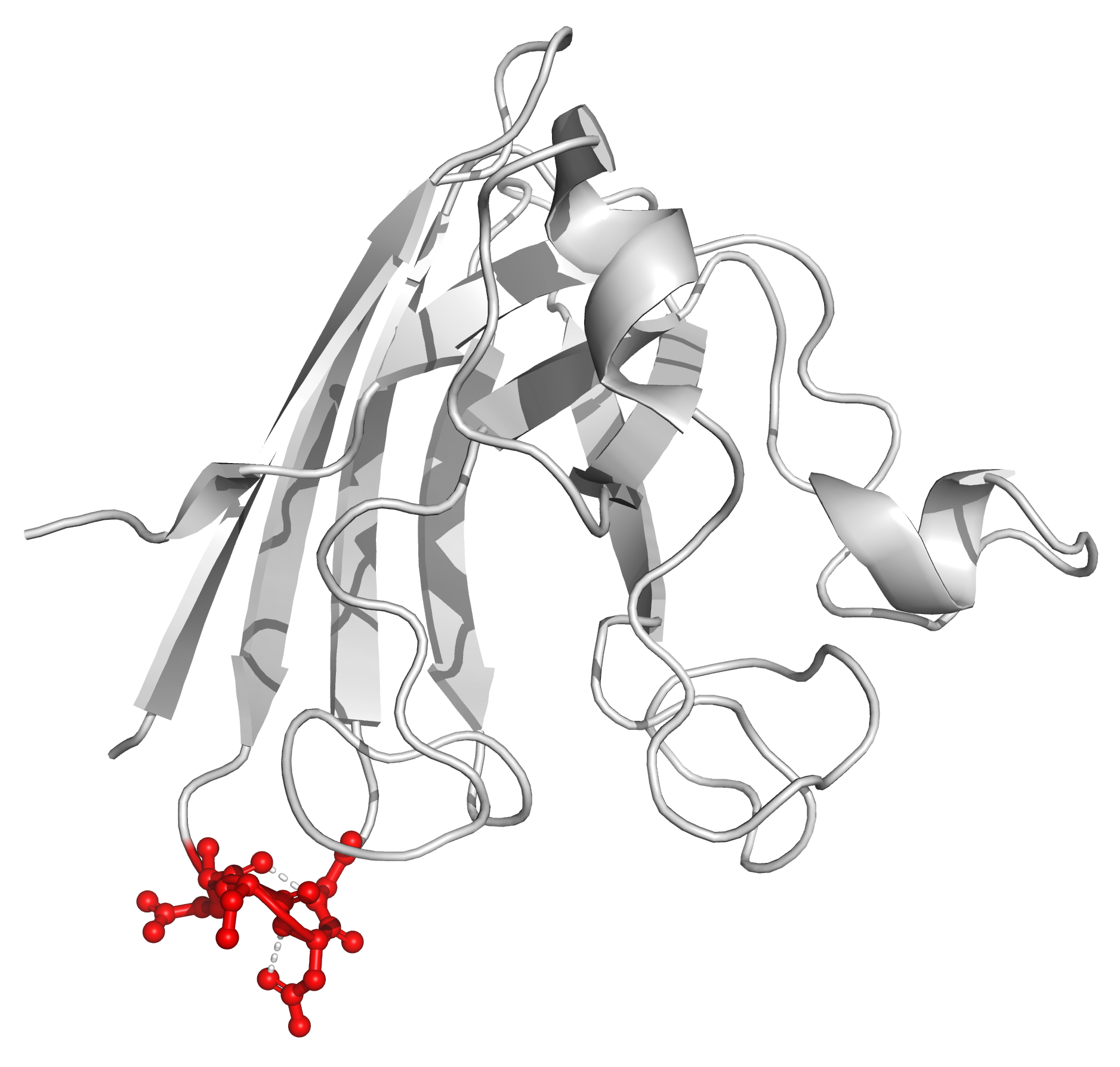
Рисунок 3b. Водородные связи между остовными атомами в петле. Участвующие в контакте аминокислотные остатки - Glu24 и Gly27 (длина связи 2.8 Å). Также изображена водородная связь между остовным атомом N и атомом O боковой цепи в остатке Asn26 (длина связи 2.8 Å). Положение остатков (отмечены красным) в структуре белка показано справа. 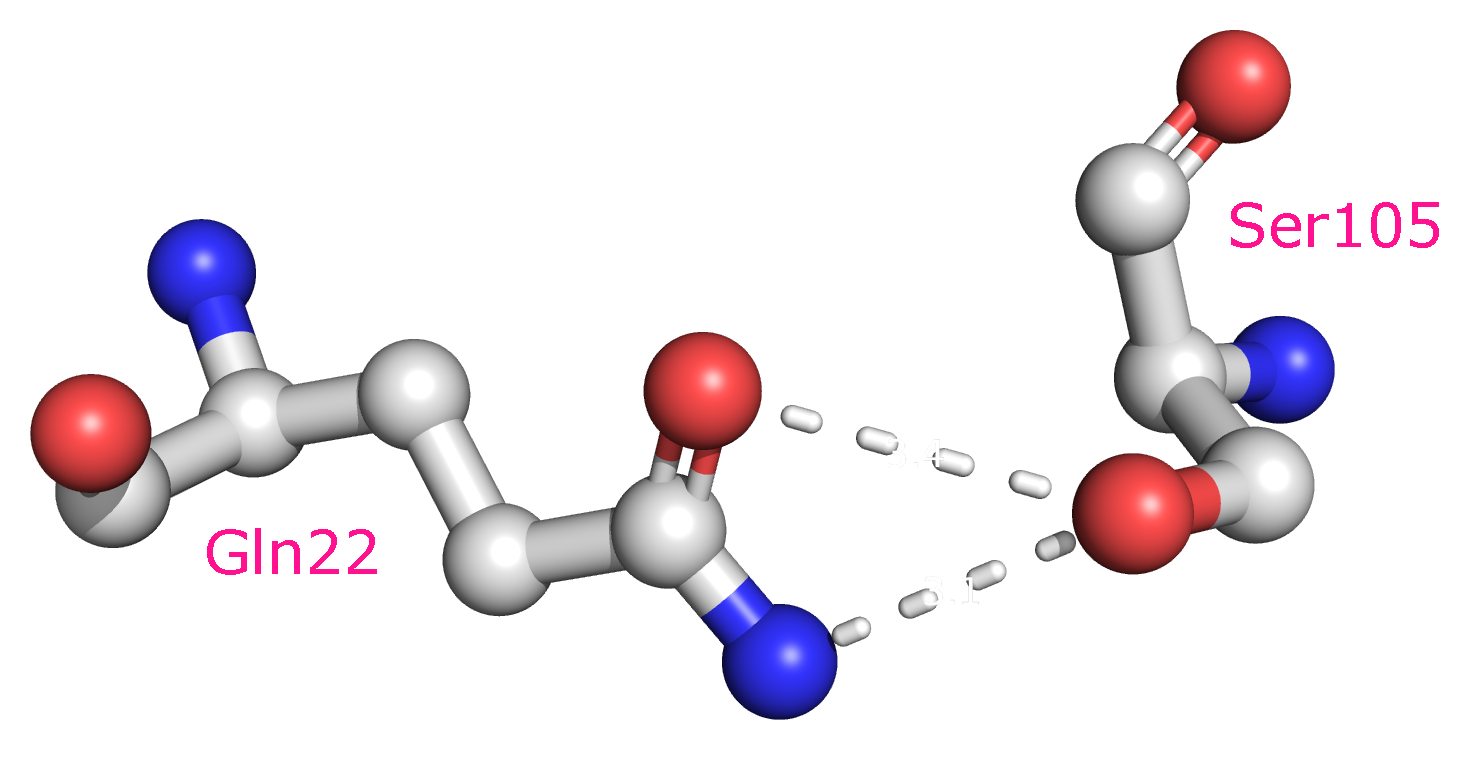
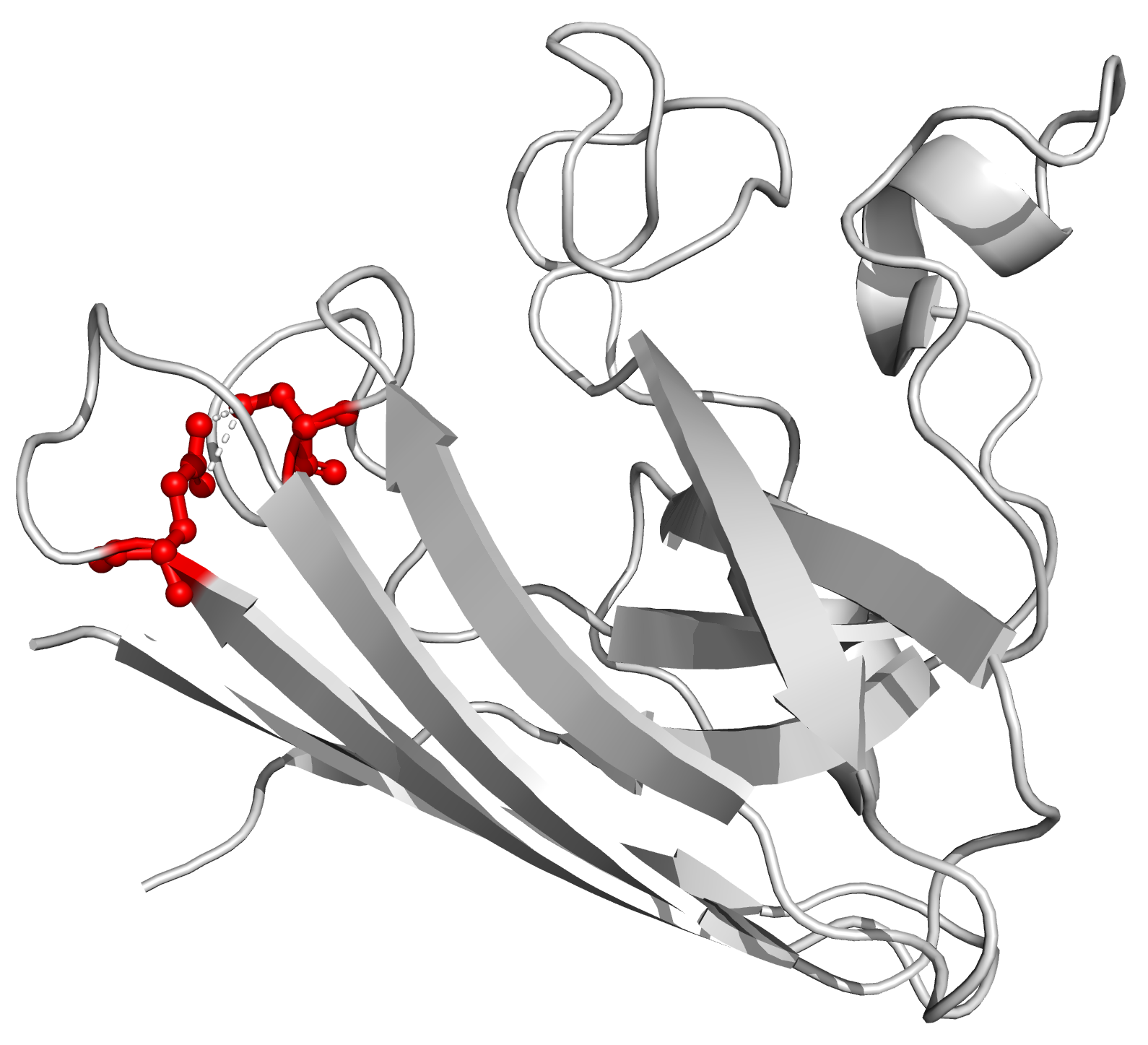
Рисунок 3c. Водородные связи между боковыми цепями аминокислот внутри глобулы белка. Участвующие в контакте аминокислотные остатки - Gln22 и Ser105. Между ними образуются две водородные связи длиной 3.4 и 3.1 Å (слева). Положение остатков (отмечены красным) в структуре белка показано справа.
Затем взаимодействия между выбранными остатками были проанализированы в ЯМР-структуре. Для каждой из 30 моделей
оценивалось расстояние между соотвествующими атомами данных остатков, которые участвуют в формировании водородной
связи. В таблице 1 представлены полученные результаты. Для каждого взаимодействия оценивался процент моделей ЯМР,
в которых присутствует водородная связь (третий столбец, %), а также минимальное, максимальное и среднее расстояния
между атомами (dmin, dmax и dmean, соответственно). Были рассмотрены все связи,
образующиеся между выбранными остатками (всего 6 штук).
Во-первых, по таблице 1 можно заметить, что водородные связи между атомами в остове белка внутри глобулы
(Leu117-Gly147, 2 первые строки) достаточно стабильны и встречаются практически в 100% ЯМР-моделей. Это
означает, что расшифровка структуры методами ЯМР и РСА достаточно точная, а остатки внутри глобулы не
обладают высокой подвижностью. При этом средняя длина водородной связи в ЯМР-структуре была ниже, чем в РСА.
Возможно, это свзяано с тем, что структуры все же немного разные и получены по разным данным.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
© Наталия Кашко, 2017 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||