|
||
|
|
В данном практикуме исследовалась поверхность белка Aha1, ко-шаперона Hsp90, из бактерии Colwellia psychrerythraea. Структура белка расшифрована методом ЯМР, в файле содержится 10 моделей. PDB ID для этой структуры: 2M89. Сначала была построена молекулярная поверхность для третьей модели из структуры (рисунок 1). 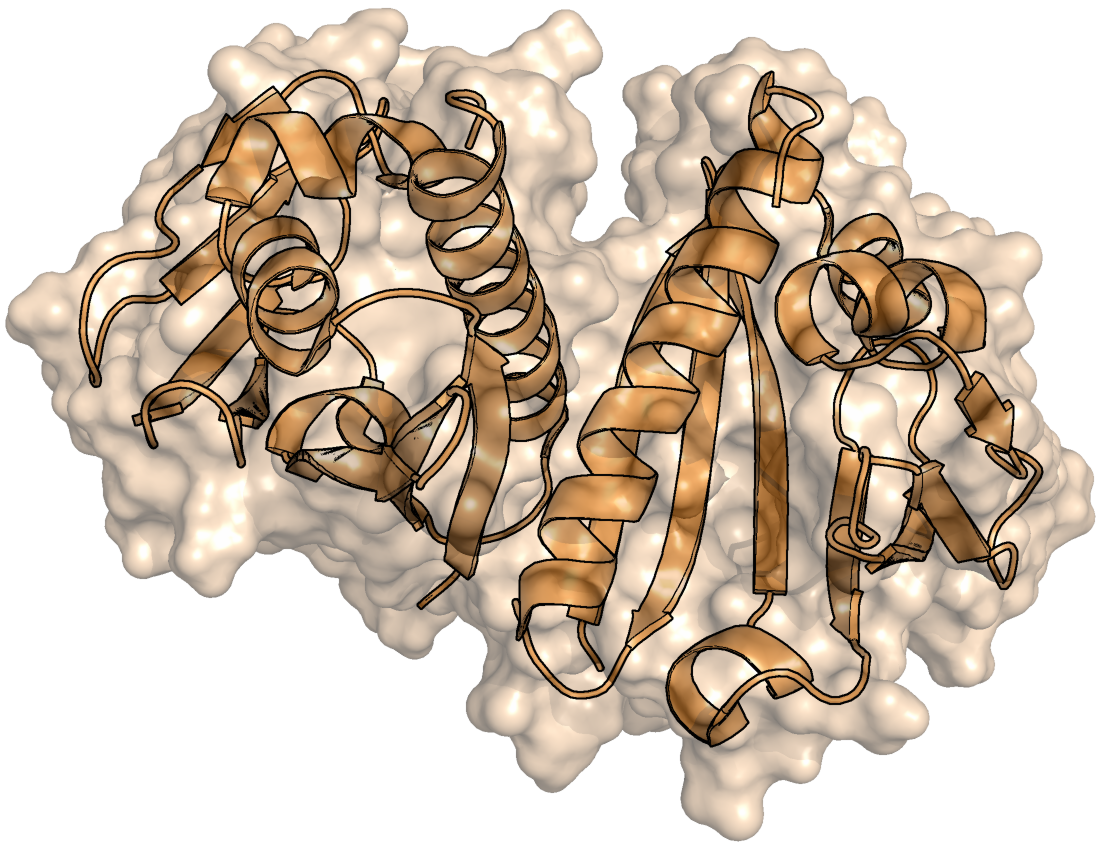
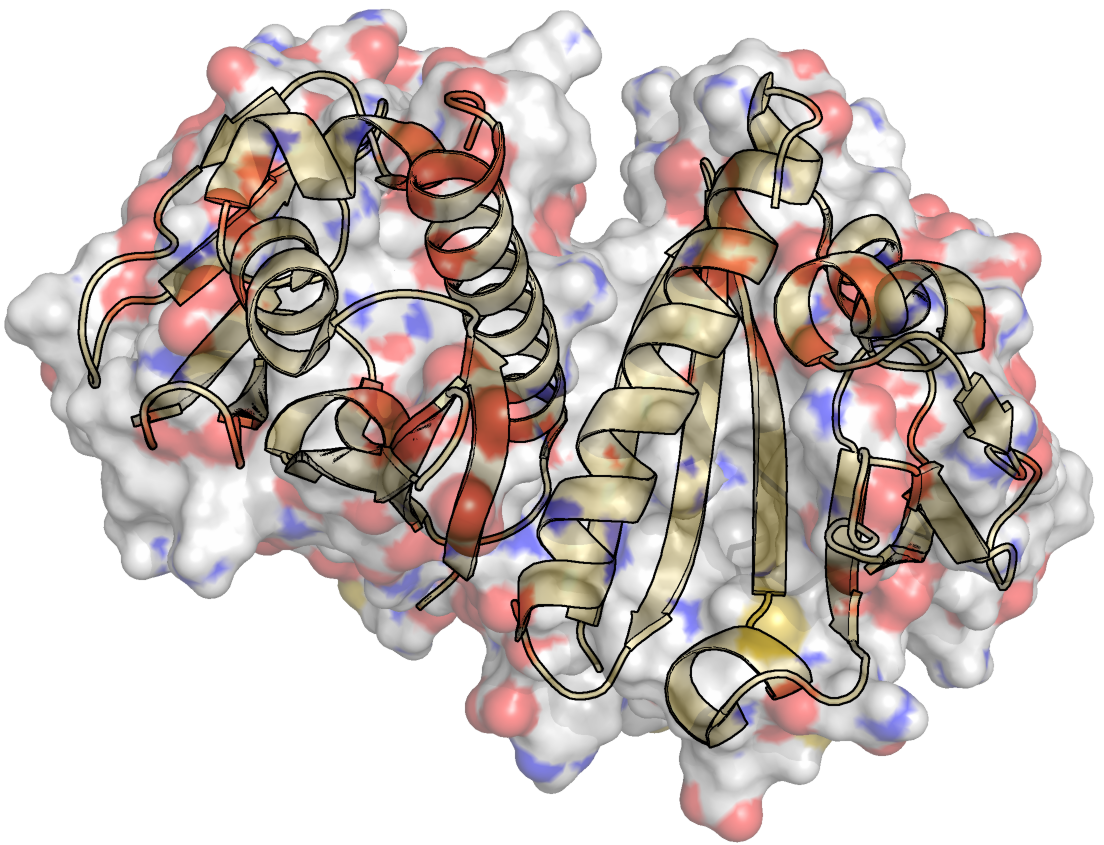
Рисунок 1. Молекулярная поверхность димера Aha1 на примере третьей модели из ЯМР-структуры 2M89. Снизу - раскраска поверхности по типу атомов (красный - кислород, синий - азот, белый - углерод, желтый - сера). Затем для всех 10 моделей была посчитана площадь поверхности двумя способами. Полученные распределения площади молекулярной поверхности (MS) и площади поверхности, доступной для растворителя (SAS), представлены на рисунках 2 и 3, соответственно. Scatter plot, отражающий совместное распределение двух видов поверхностей изображен на рисунке 4. Рисунок 2. Распределение площади молекулярной поверхности (в квадратных ангстремах) по всем 10 моделям из ЯМР-структуры 2M89. Рисунок 3. Распределение площади поверхности SAS (в квадратных ангстремах) по всем 10 моделям из ЯМР-структуры 2M89. Рисунок 4. Совместное распределение площади молекулярной поверхности (по оси абсцисс) и поверхности SAS (по оси ординат) по всем 10 моделям из ЯМР-структуры 2M89. Номер модели указан у каждой точки на графике. Приведена линейная аппроксимация, предложенная Excel.
Из рисунков 2-4 видно, что первая модель наиболее выбивается среди остальных: в этой модели очень высокая площать
поверхности SAS. У всех остальных моделей площадь поверхности SAS изменяется незначительно и без выраженных закономерностей.
То же самое можно сказать и про площадь молекулярной поверхности. Флуктуации площади в этом случае были больше, но и
среднее значение площади MS больше. В целом, для молекулярной поверхности также сложно отследить закономерность
распределения площади по моделям. Некоторые модели (например, 3 и 9) имеют чуть большую площадь, другие (1, 4, 10) - чуть
меньшую. Возможно, это связано с наличием "открытой" и "закрытой" конформаций, но я не заметила сильных изменений в
конформации белка или форме поверхности в разных моделях. Поэтому, скорее всего, все эти изменения вызваны случайными
причинами.
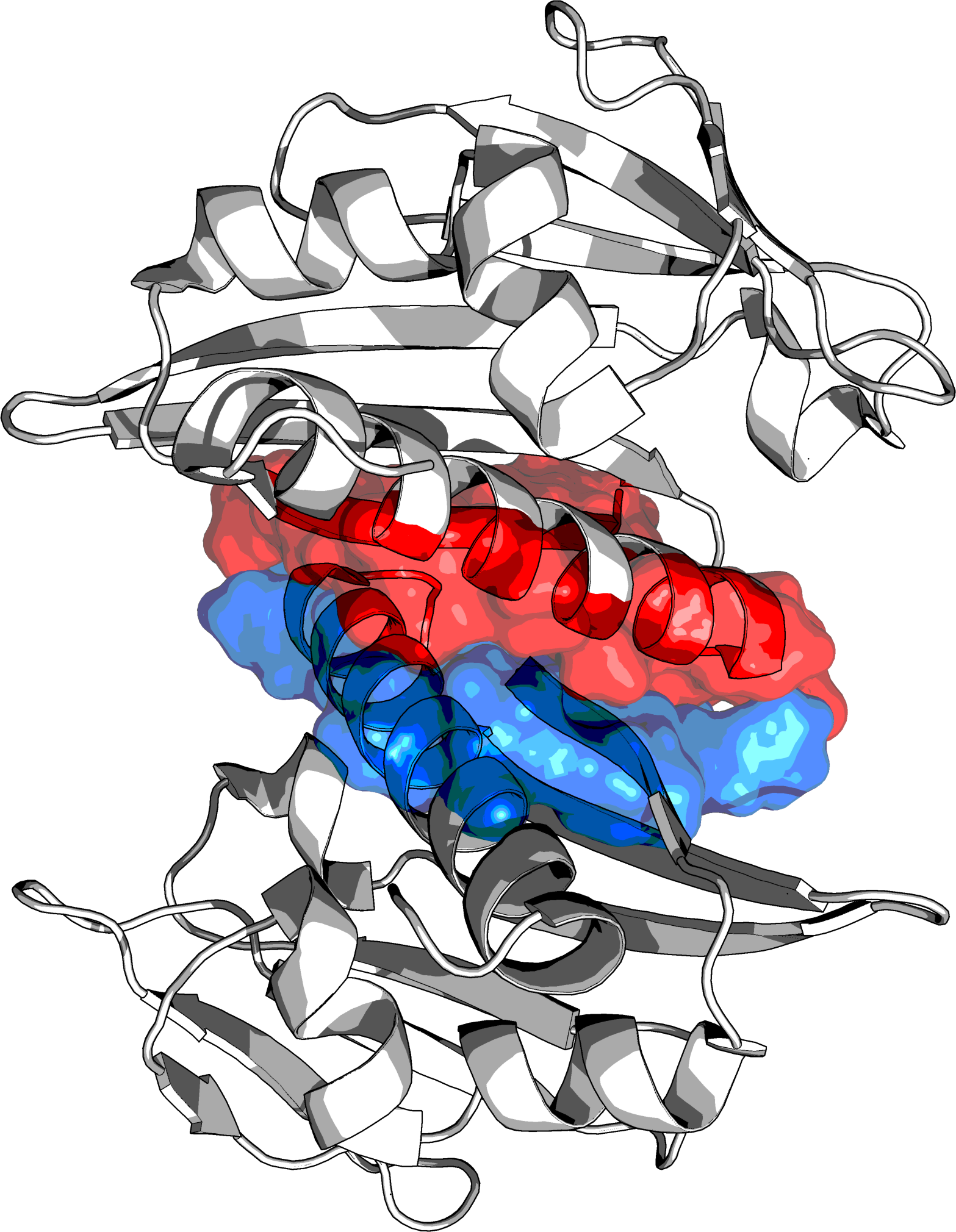
Далее была исследована поверхность контакта между двумя субъединицами белка. Для этого было выделено два множества остатков на границе этих субъединиц. Список использованых команд:
|
create chA, byres chain A and str_0003 and (chain B around 3.5)
create chB, byres chain B and str_0003 and (chain A around 3.5) show surface, chA show surface, chB set surface_color, red, chA set surface_color, marine, chB set transparency, 0.3 |