|
|
|
|
В этом практикуме было построено изображение электронной плотности для белка Cu,Zn-супероксиддисмутазы (Cu,Zn-СОД) человека (PDB ID:
1PU0, информация на сайте EMBL:
1PU0). Для этой структуры были скачаны файлы
с самой структурой (1pu0.ent) и с экспериментально полученной картой
электронной плотности (EMP map, 1pu0.ccp4).
Данная структура была получена американскими учеными в работе 2003 года (PMID: 12963370). В своем исследовании они проанализировали структуры нормального (1PU0) и мутантного (1PTZ) вариантов Cu,Zn-СОД человека и обнаружили, что замена H43R (как, возможно, и множество других точечных замен) приводит к снижению стабильности белка и к облегчению формирования филаментов. Мутантные варианты Cu,Zn-СОД встречаются у людей с тяжелым нейродегенеративным заболеванием - семейным боковым амиотрофическим склерозом (familial amyotrophic lateral sclerosis, FALS). По результатам статьи, вероятно, именно склонность мутантных форм фермента к образованию филаментных струкутр приводит к развитию этого заболевания. На рисунке 1 представлено изображение полной структуры (асимметрической единицы) 1pu0 с визуализацией электронной плотности (уровень подрезки 1.5). Так как эта структура достаточно большая и неудобная для работы, было решено проводить все дальнейшие манипуляции только с одной из цепей белка (рисунок 2). 
Рисунок 1. Структура Cu,Zn-супероксиддисмутазы человека 1PU0 с изображением электронной плотности на уровне подрезки 1.5. Цепь белка выделена красным. В асимметрическую единицу входит 10 идентичных пептидных цепей. 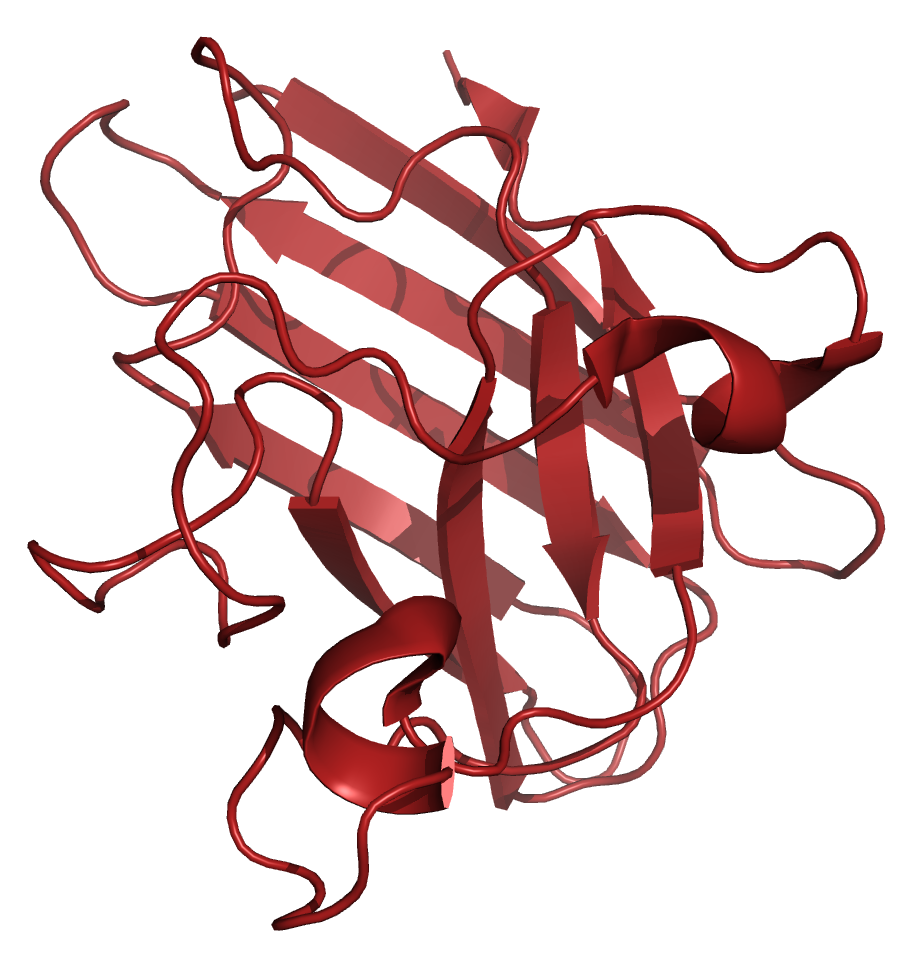
Рисунок 2. Структура одной из цепей фермента.
Для одной из цепей белка были получены изображения электронной плотности вокруг остова полипептидной цепи на уровнях подрезки 1.5, 2.5 и 3.5 (рисунок 3).
Также можно посмотреть анимацию, в которой происходит последовательное увеличение уровня обрезки с 1 до 4 (рисунок 4). Все изображения
электронной плотности были построены с carve=2.
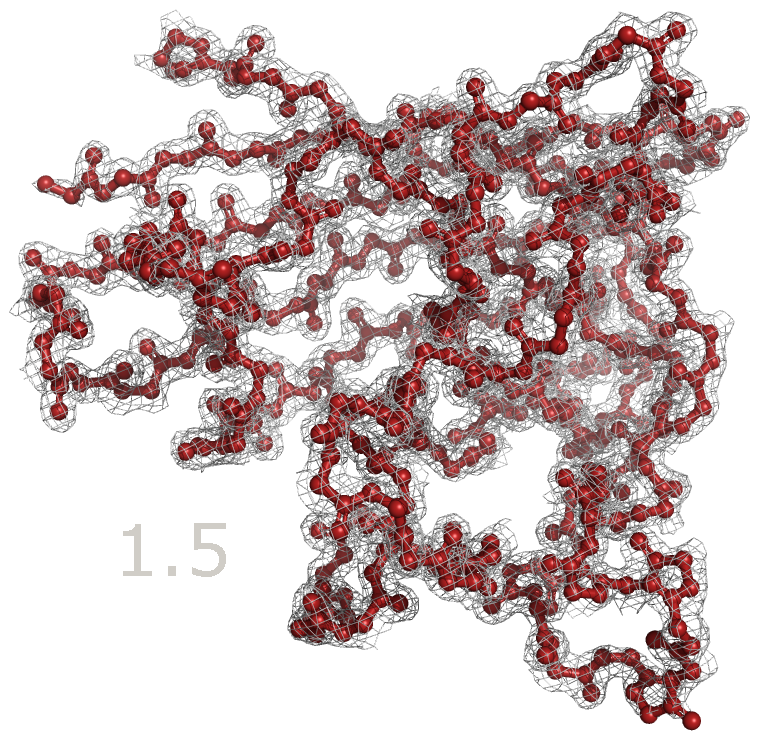
Рисунок 3a. Структура остова полипептидной цепи одной из цепей фермента (выделен красным) с изображением электронной плотности на уровне подрезки 1.5. 
Рисунок 3b. Уровень подрезки 2.5. 
Рисунок 3с. Уровень подрезки 3.5. 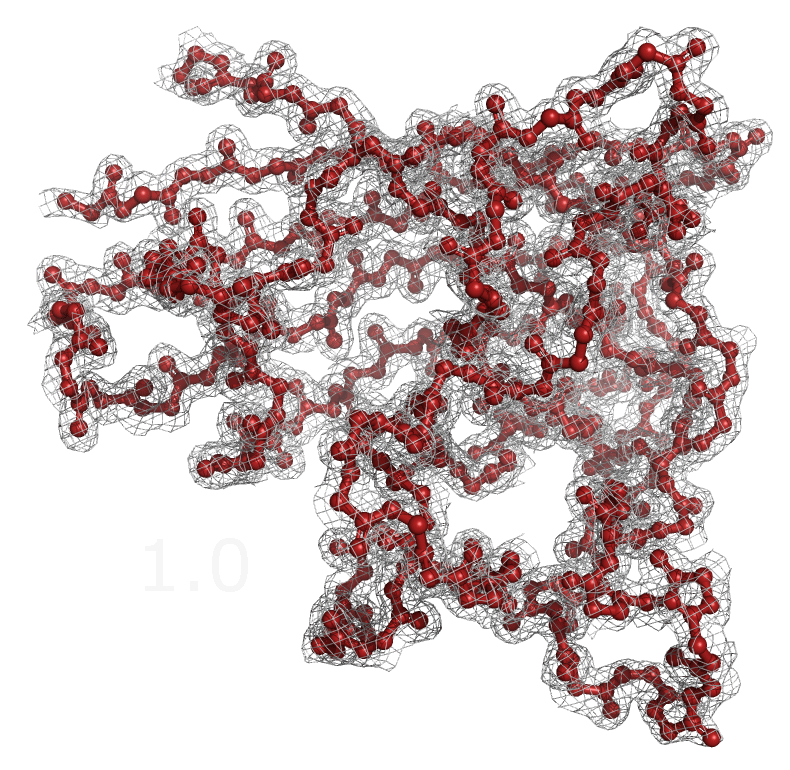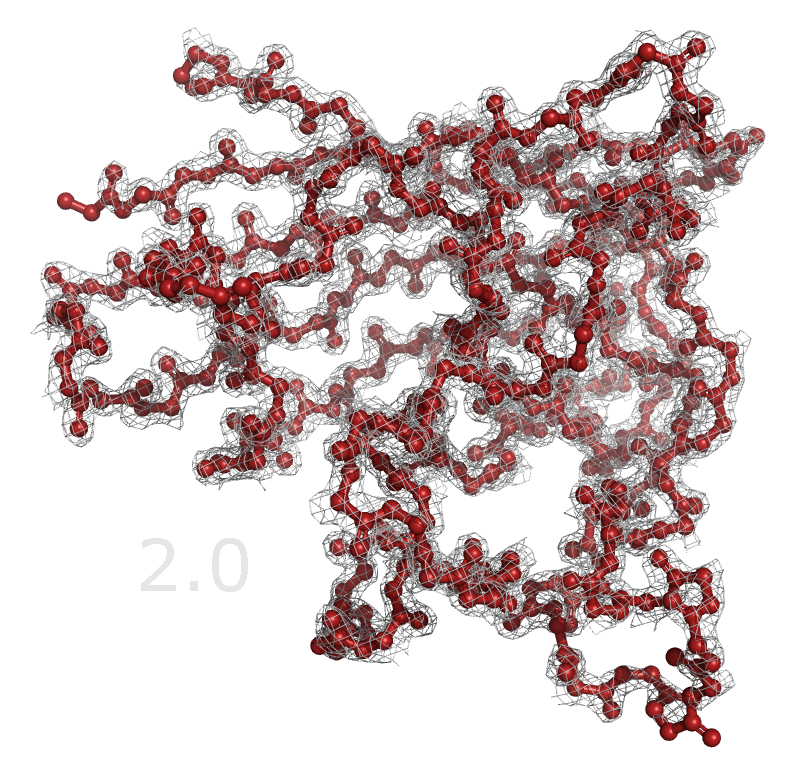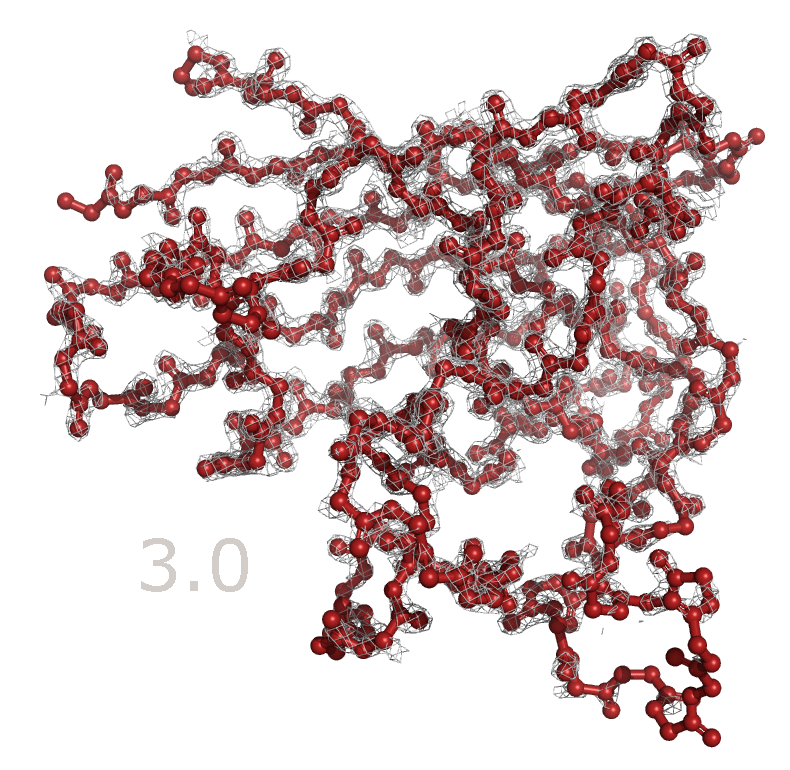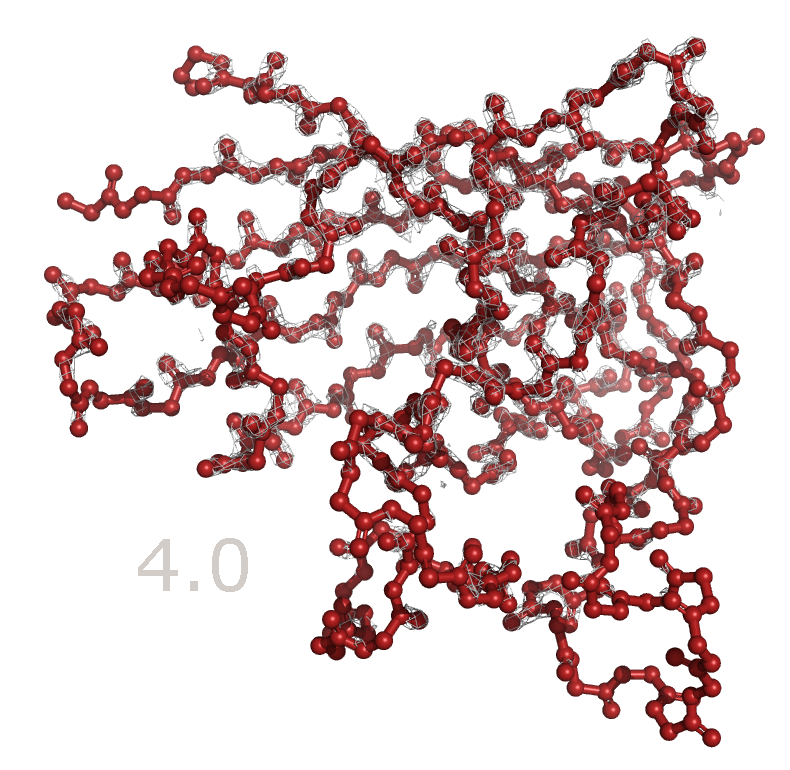
Рисунок 4. Изменение распределения электронной плотности вокруг остова белка при увеличении уровня подрезки от 1 до 4. Как видно из рисунков 3 и 4, электронная плотность сконцентрирована вокруг остова полипептидной цепи и в целом отражает расположение атомов белка. Однако уже на уровне подрезки 1.5 не все атомы оказываются внутри поверхности электронной плотности. В основном такие участки располагаются в петлях белковой цепи, а внутри глобулы белка электронная плотность остается даже на уровне подрезки 4. Возможно, петли белка более подвижны и из-за этого они хуже кристаллизуются, поэтому значения распределения электронной плотности в области петель в среднем ниже, чем внутри глобулы. Также были построены изображения электронной плотности для отдельных аминокислотных остатков. Для этого были выбраны аминокислоты, отличающиеся по структуре и функциональным группам: Val47, His48 и Glu49 (рисунок 5). Визуализация распределения электронной плотности на уровнях подрезки 1.5, 2.5 и 3.5 представлена на рисунке 6. Также, опять же, можно посмотреть анимацию, в которой происходит последовательное увеличение уровня обрезки с 1 до 4 (рисунок 7). 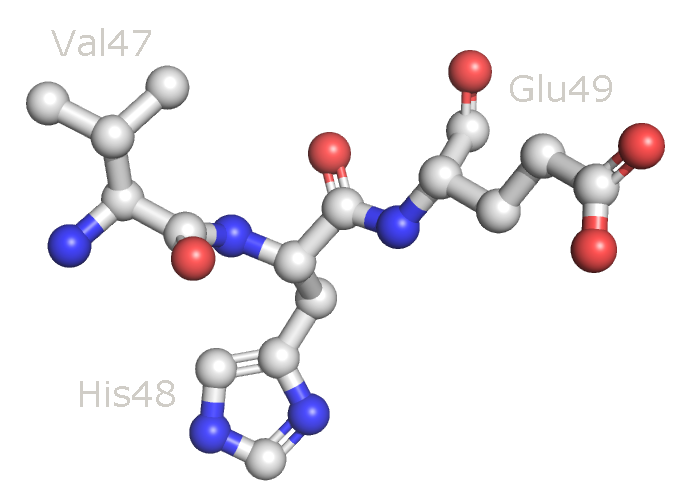
Рисунок 5. Аминокислотные остатки, выбранные для работы: Val47, His48 и Glu49. Атомы покрашены по стандартной цветовой схеме PyMol по типу атома (C - серый, N - синий, O - красный). 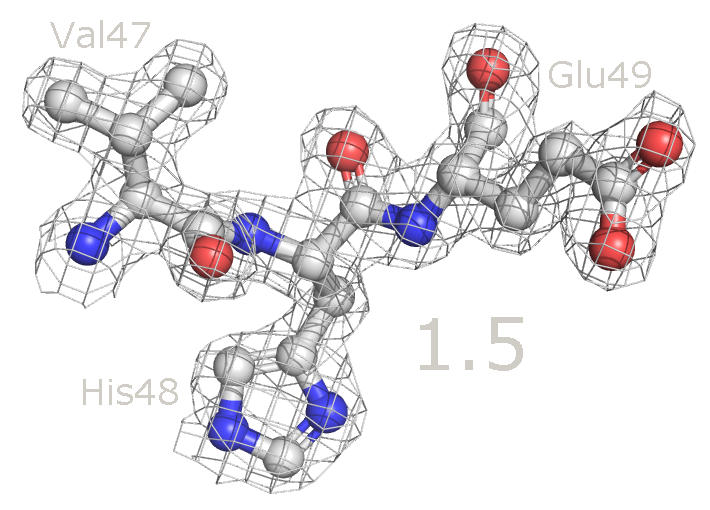
Рисунок 6a. Выбранные аминокислотные остатки с изображением электронной плотности на уровне подрезки 1.5. 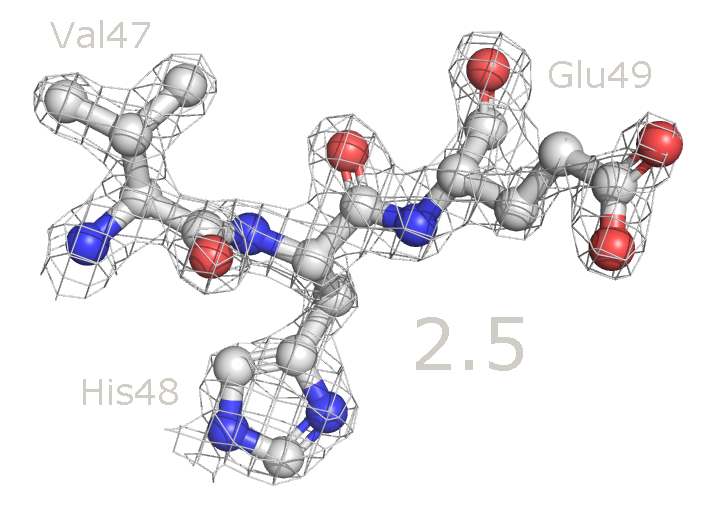
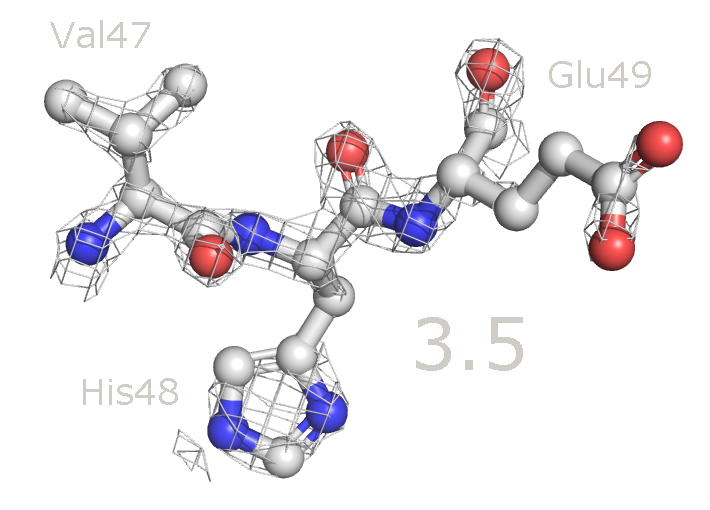
Рисунок 6b. Уровень подрезки 2.5 (слева) и 3.5 (справа). 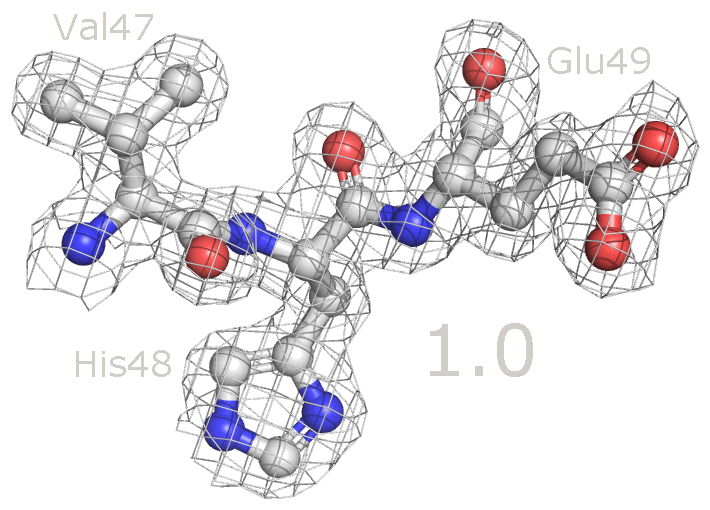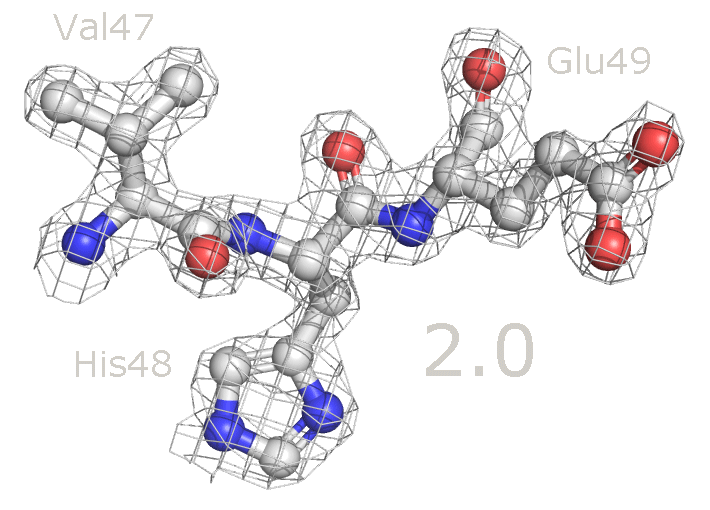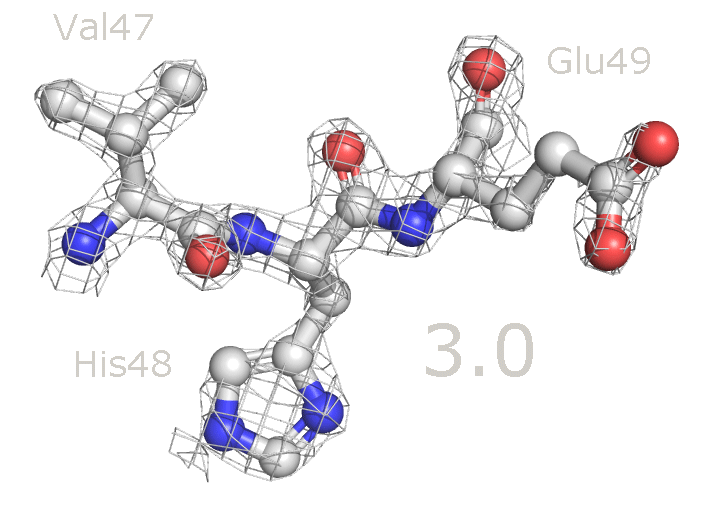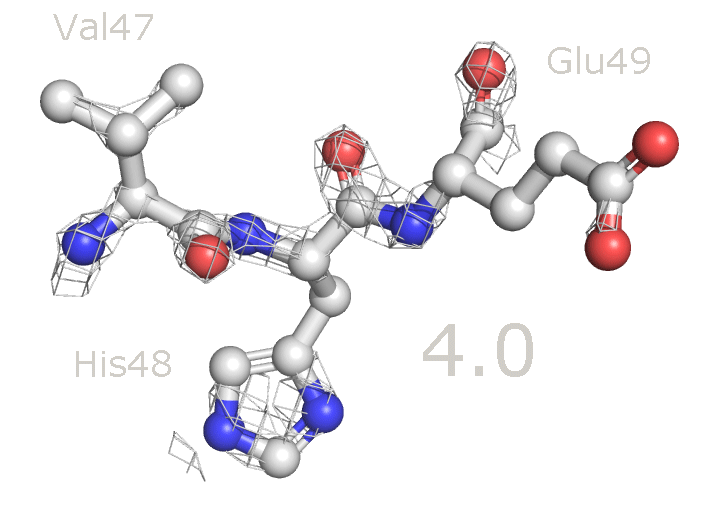
Рисунок 7. Изменение распределения электронной плотности вокруг аминокислотных остатков при увеличении уровня подрезки от 1 до 4. Для данных аминокислотных остатков по респределению электронной плотности достаточно точно можно определить положение атомов и тип аминокислоты. При уменьшении уровня подрезки в первую очередь электронная плотность исчезает с C-атомов радикальных групп. На уровне подрезки 4 в основном электронная плотность остается внутри имидазольного кольца гистидина (так как это ароматическая система), а также на электрон-избыточных атомах азота в полипептидной цепи.
В структуру Cu,Zn-СОД также входят ионы Cu и Zn. Мне показалось интересным изобразить электронную плотность в местах связывания
ионов металлов с белком.
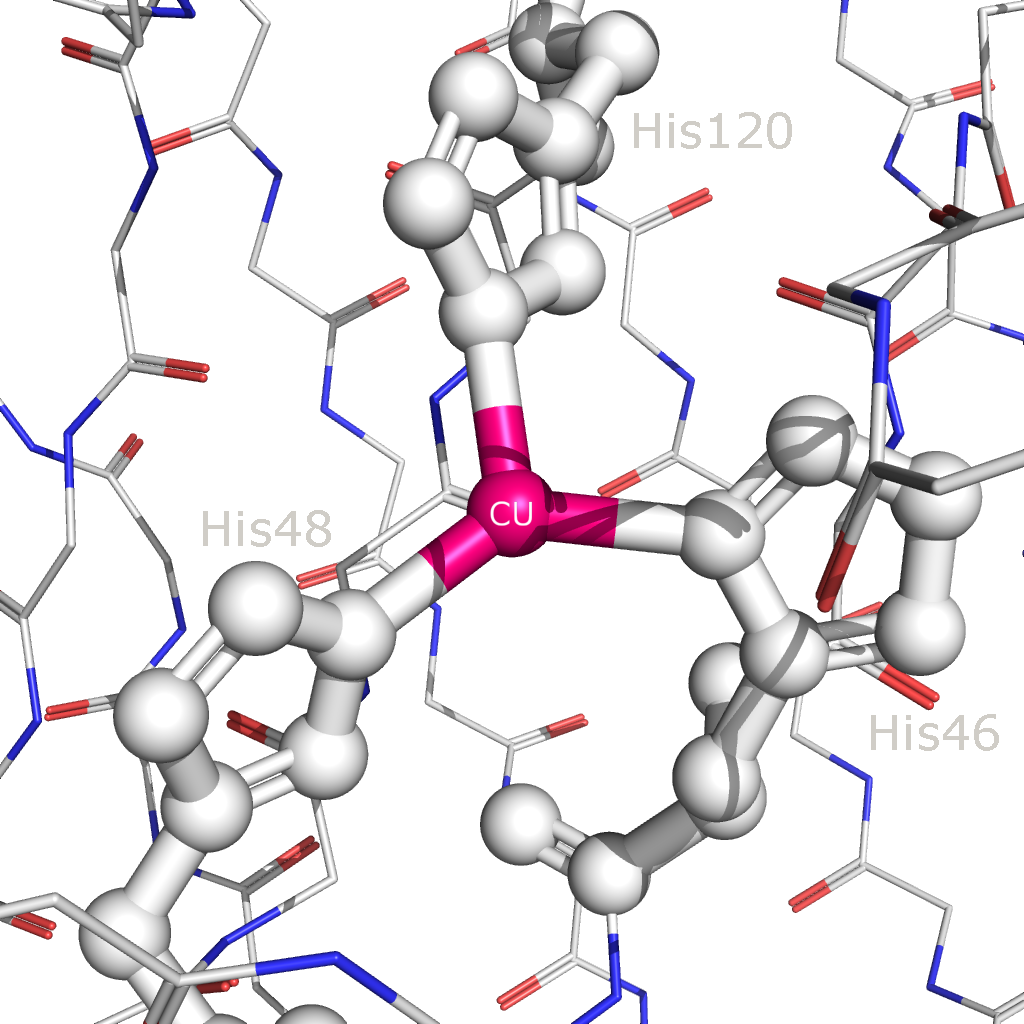
Рисунок 8. Связывание иона меди (выделен розовым) с аминокислотными остатками Cu,Zn-СОД. Остатки, участвующие в связывании выделены и покрашены в белый. Остов полипептидной цепи покрашен в соответствии со стандартной цветовой схемой PyMol. 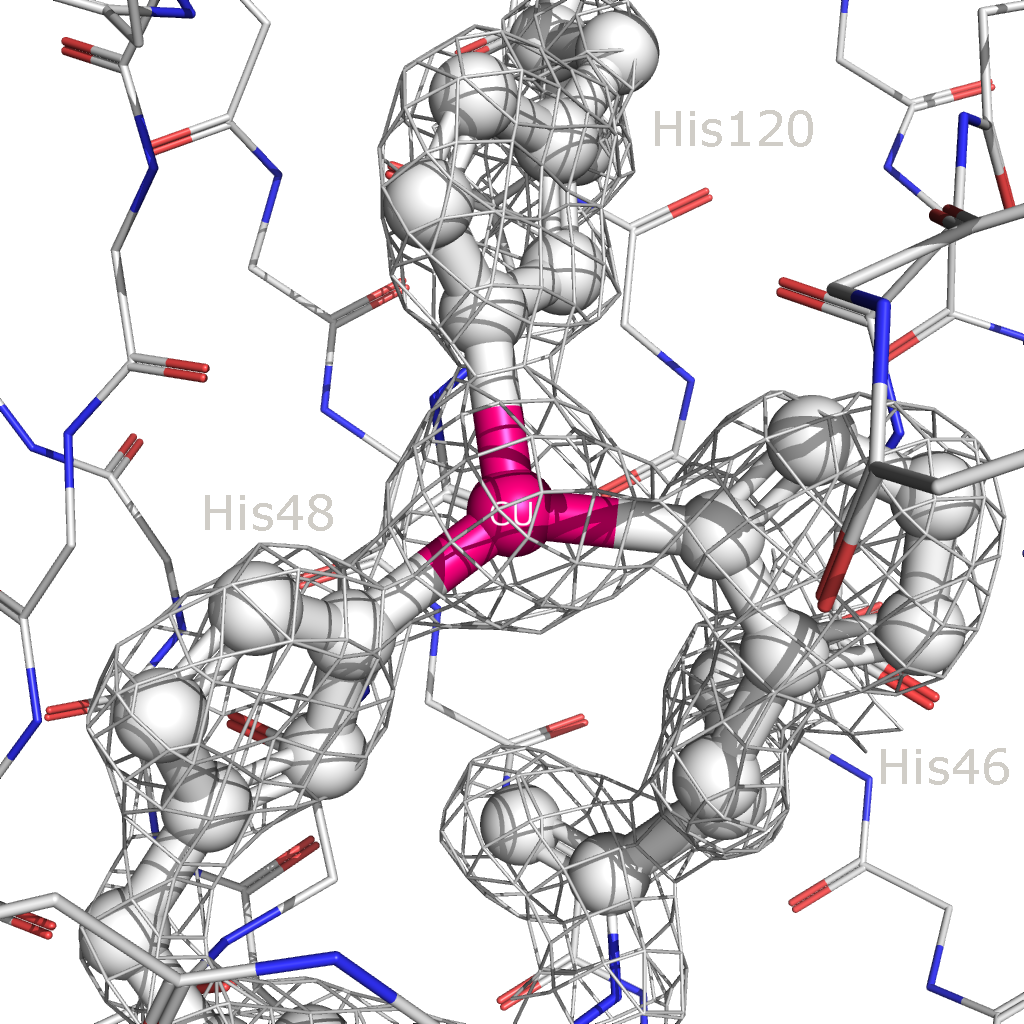
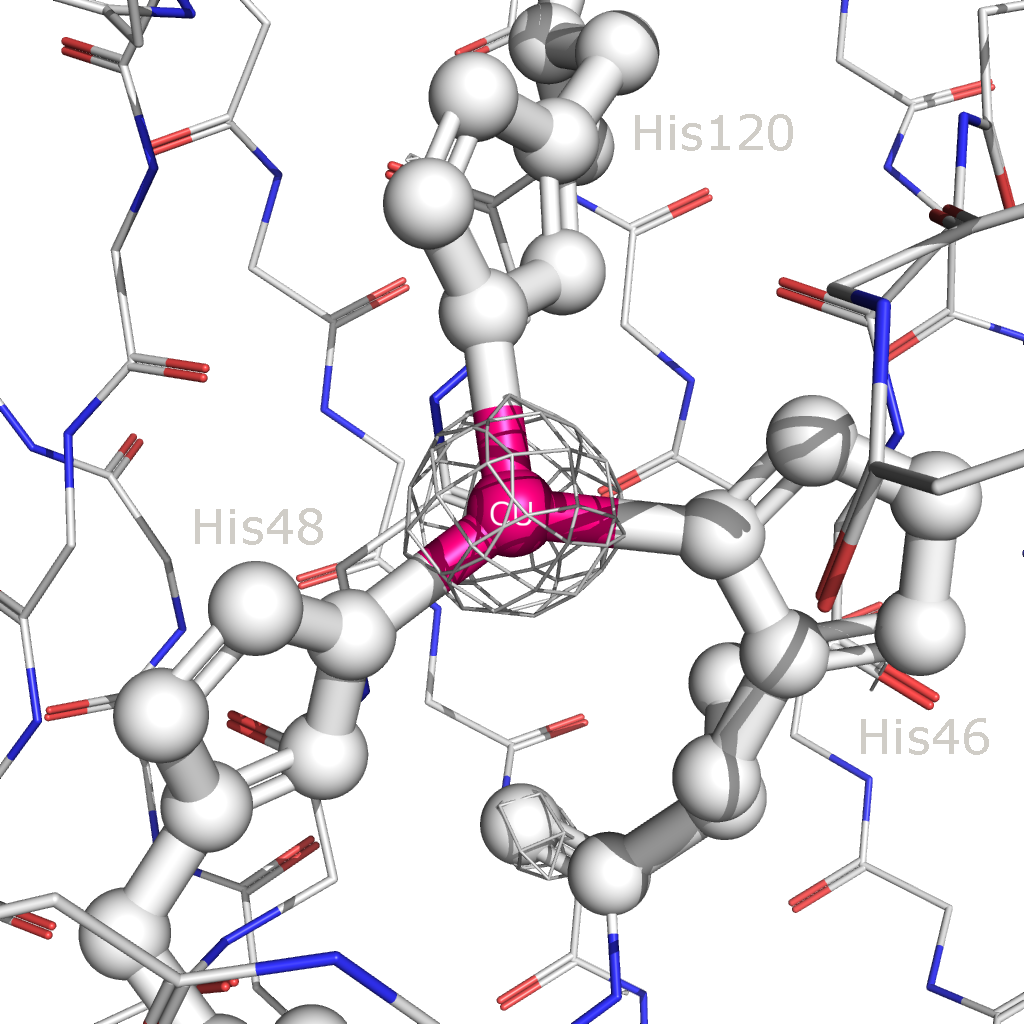
Рисунок 9. Изображение электронной плотности вокруг участка связывания меди на уровнях подрезки 2.5 (слева) и 6 (справа). Аналогичным образом было изучено взаимодействие белка с ионом цинка. На рисунке 10 представлено изображение области связывания иона цинка с аминокислотными остатками белка. За это связывание отвечают три гистидина и один аспартат: His63, His71, His80 и Asp83, связывание с ионом металла просиходит через атомы азота в ароматическом кольце гистидина и через карбоксигруппу боковой цепи аспартата. На рисунке 11 представлены изображения электронной плотности на уровне подрезки 2.5 и 6. 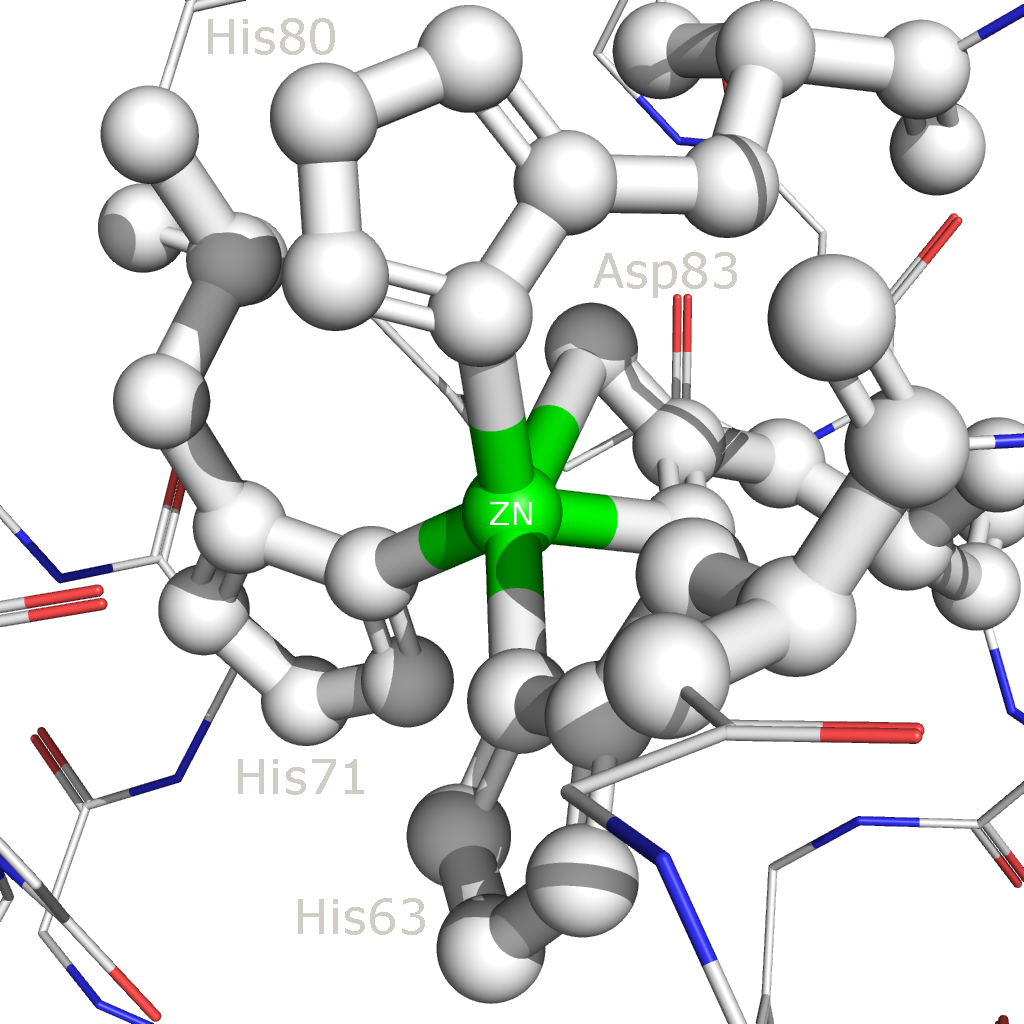
Рисунок 10. Связывание иона цинка (выделен зеленым) с аминокислотными остатками Cu,Zn-СОД. Остатки, участвующие в связывании выделены и покрашены в белый. Остов полипептидной цепи покрашен в соответствии со стандартной цветовой схемой PyMol. 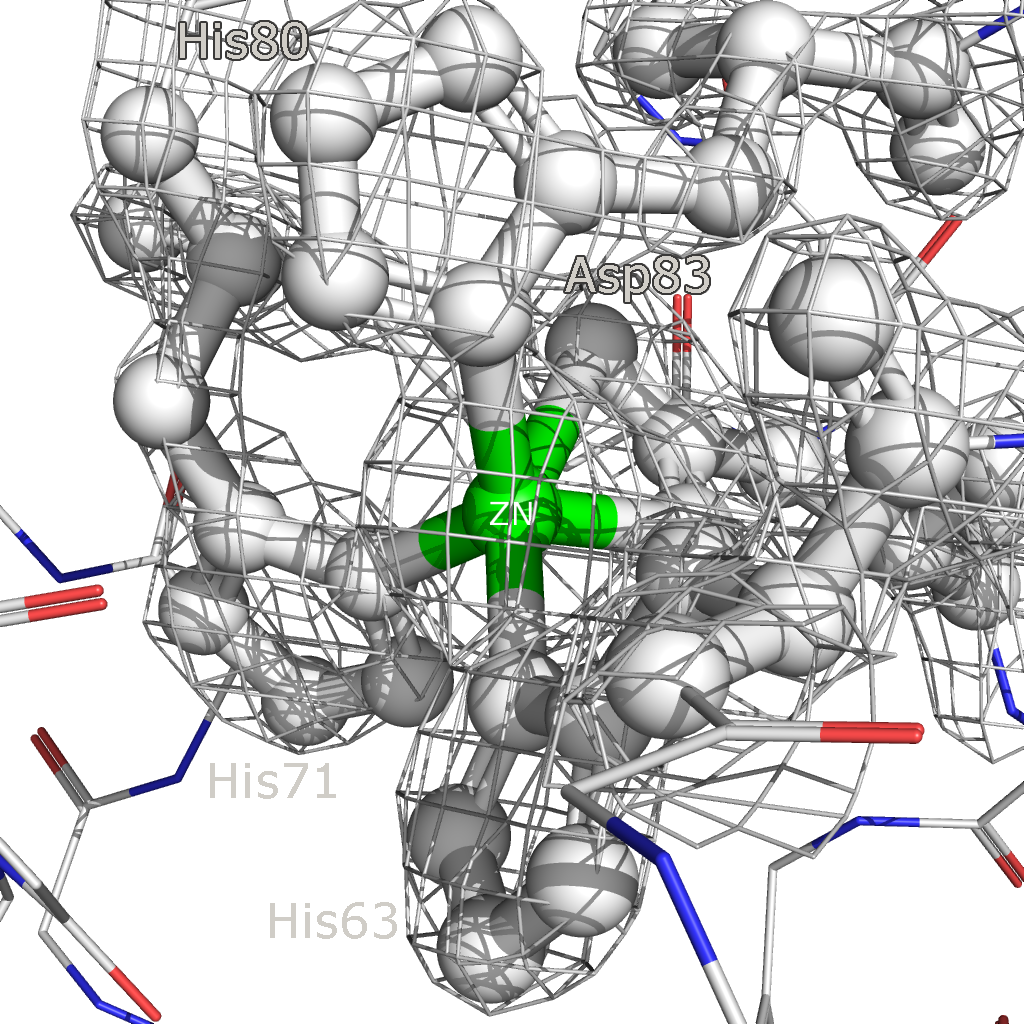
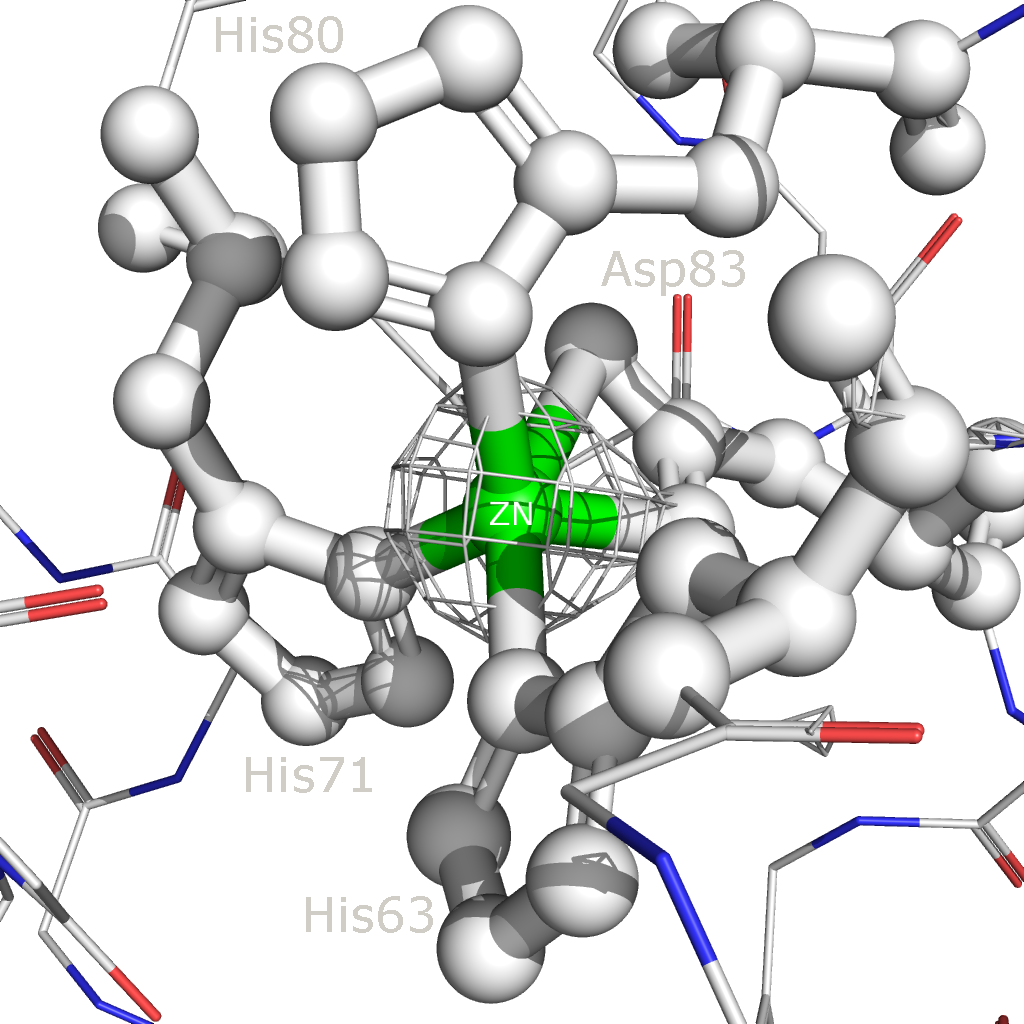
Рисунок 11. Изображение электронной плотности вокруг участка связывания цинка на уровнях подрезки 2.5 (слева) и 6 (справа). В данном случае вокруг атомов Zn и Cu электронная плотность очень велика: на уровне подрезки 6 электронная плотность сохраняется только в этих участках. При связывании аминокислотных остатков белка с ионами этих металлов Cu и Zn оттягивают на себя электроны с N-атомов гистидина и O-атомов аспартата, поэтому электронная плотность на атомах металлов значительно увеличивается. |
|
© Наталия Кашко, 2017 |
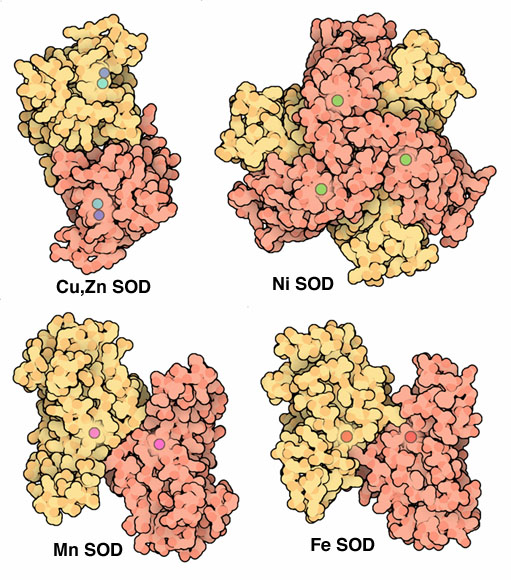 Супероксиддисмутаза - оксидоредуктаза, катализирующая распад супероксид-радикала на кислород и перекись водорода. Это один из
антиоксидантных ферментов, защищающих клетку от активных форм кислорода.
Выделяют три основных вида супероксиддисмутаз: содержащие
в активном центре ионы Cu, Mn или Fe. Наиболее распространенной формой является Cu,Zn-СОД,
присутствующая в цитоплазме. Ион меди участвует в каталитической реакции, в то время как ион цинка стабилизирует фермент
в необходимой конформации. В митохондриях распространена Mn-СОД, а большинство бактерий содержат форму фермента с ионом Fe
(Fe-СОД) или, реже, с ионом Ni (Ni-СОД).
Супероксиддисмутаза - оксидоредуктаза, катализирующая распад супероксид-радикала на кислород и перекись водорода. Это один из
антиоксидантных ферментов, защищающих клетку от активных форм кислорода.
Выделяют три основных вида супероксиддисмутаз: содержащие
в активном центре ионы Cu, Mn или Fe. Наиболее распространенной формой является Cu,Zn-СОД,
присутствующая в цитоплазме. Ион меди участвует в каталитической реакции, в то время как ион цинка стабилизирует фермент
в необходимой конформации. В митохондриях распространена Mn-СОД, а большинство бактерий содержат форму фермента с ионом Fe
(Fe-СОД) или, реже, с ионом Ni (Ni-СОД).
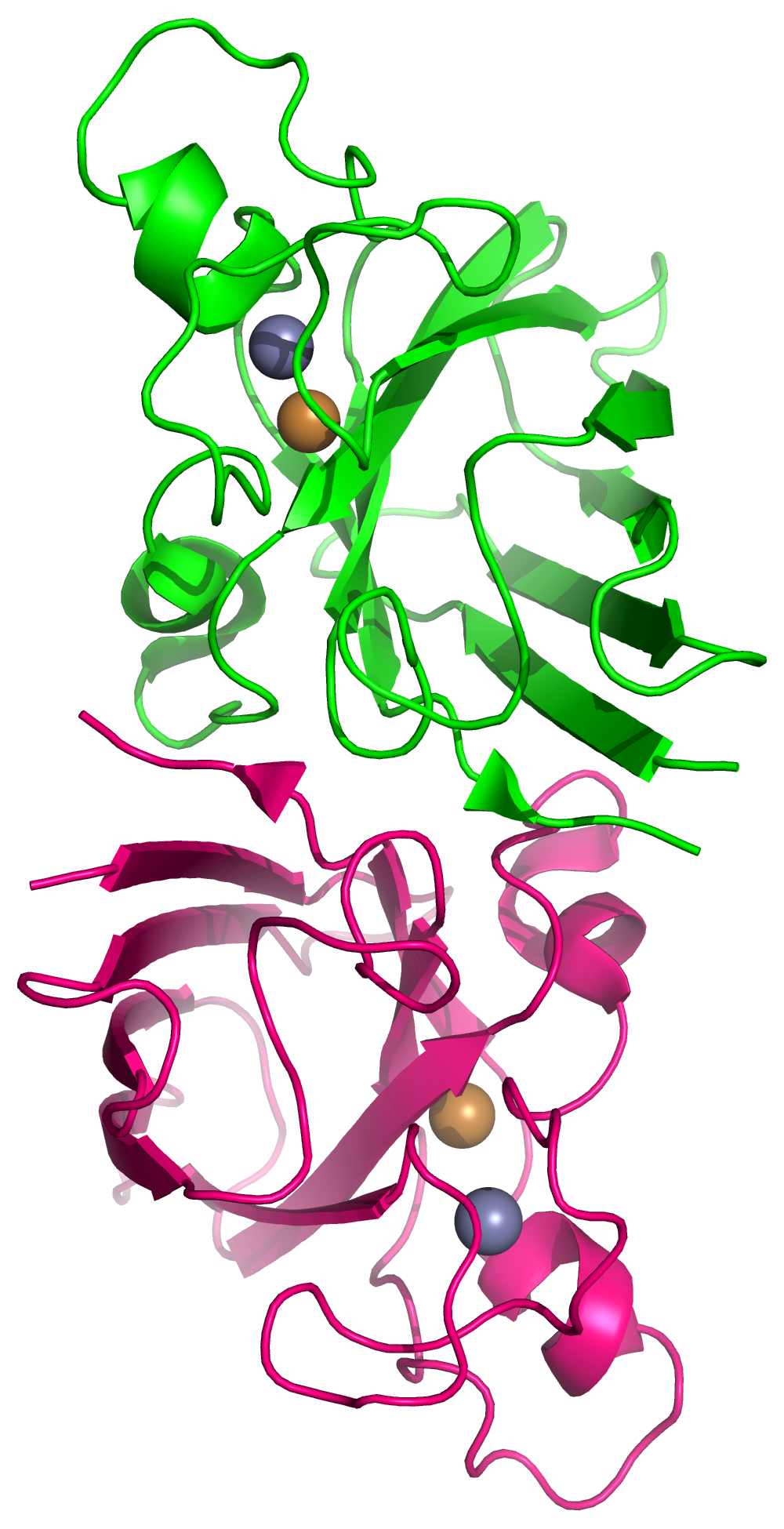 Каждая из субъединиц Cu,Zn-СОД содержит по одному иону меди и цинка. Стоит отметить, что функционально активный фермент
находится в клетке форме димера, состощего из двух одинаковых полипептидных цепей. Таким образом, на рисунке 1 мы видим пять биологических единиц белка.
На рисунке слева изображен функционально активная Cu,Zn-СОД, состоящая из двух субъединиц (отмечены розовым и зеленым).
Также сферами изображены ионы меди (коричневый) и цинка (синий).
Каждая из субъединиц Cu,Zn-СОД содержит по одному иону меди и цинка. Стоит отметить, что функционально активный фермент
находится в клетке форме димера, состощего из двух одинаковых полипептидных цепей. Таким образом, на рисунке 1 мы видим пять биологических единиц белка.
На рисунке слева изображен функционально активная Cu,Zn-СОД, состоящая из двух субъединиц (отмечены розовым и зеленым).
Также сферами изображены ионы меди (коричневый) и цинка (синий).