Белок Bet v 1 (из березы, Betula verrucosa) был получен методами ЯМР (PDB код: 1B6F) и РСА (PDB код: 1BV1). В ЯМР-структуре содержится 23 модели. Разрешение РСА-модели - 2 Å. На Рис. 1 и 2 представлены ЯМР и РСА модели белка Bet v 1. В целом, вторичные структуры белка, предстказанные РСА и ЯМР, очень похожи, однако положение петель и концы цепей существенно различаются.
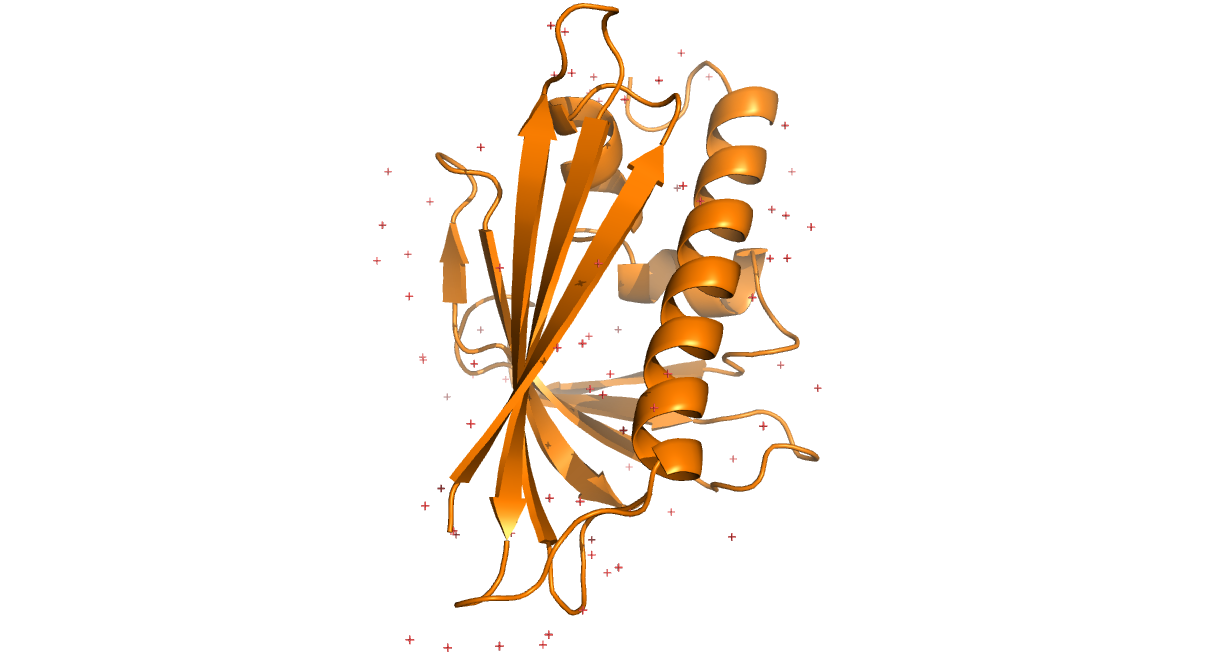
Рис. 1. Cтруктура 1BV1, полученная методом РСА. Разрешение 2 Å.
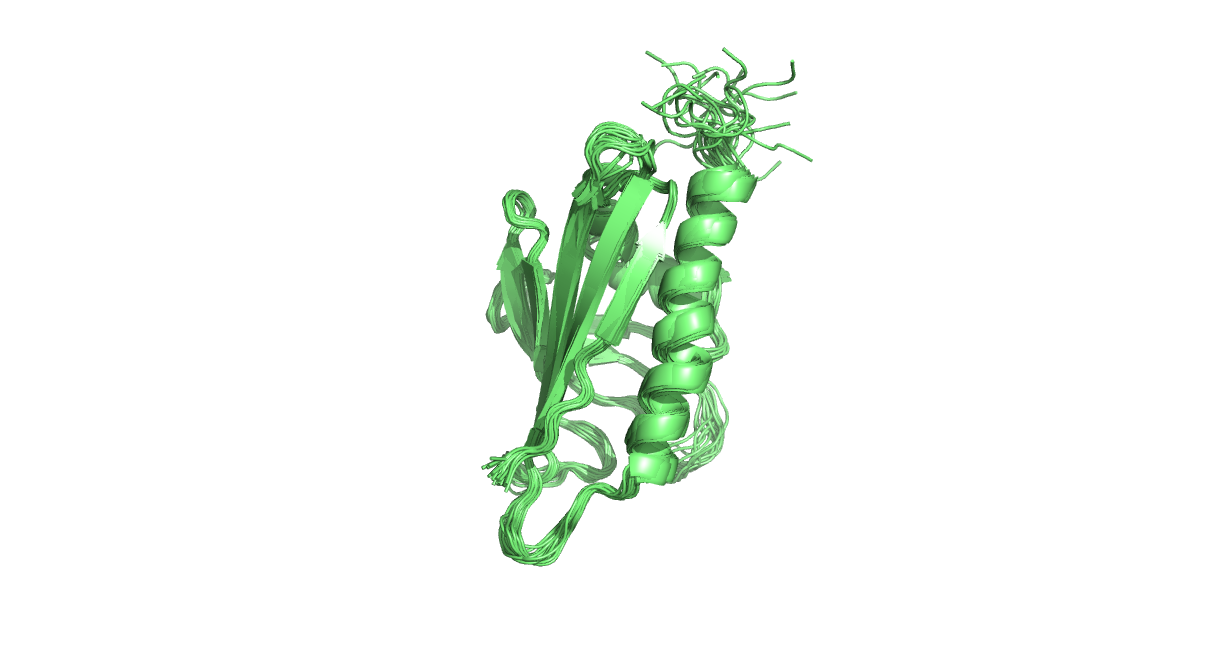
Рис. 2. ЯМР-структура 1B6F. Изображены все 23 модели.
Я выбрала следующие водородные связи для анализа в РСА:
- остовная в ядре белка, в бета-листе: между Ser117 и Glu101;
- водородная связь боковых цепей в ядре белка: Asn100 и Asn118;
- водородная связь в петлях, выходящих на поверхность глобулы: Asn78 и Asp75.
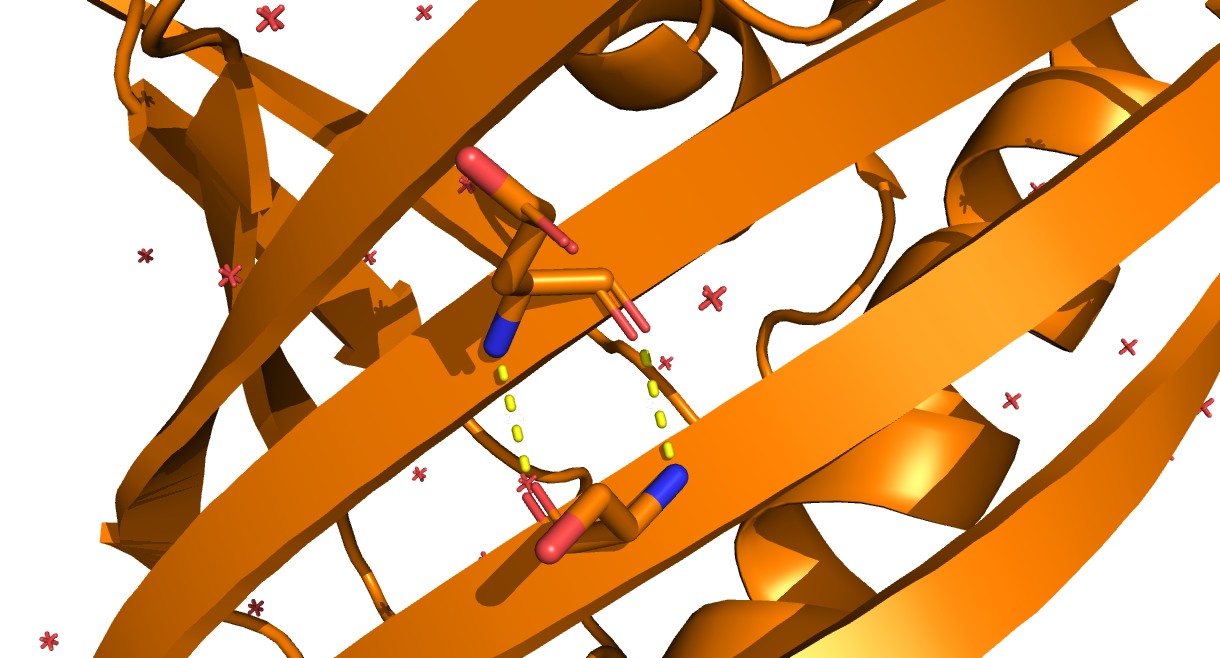
Рис. 3. Водородные связи между остовными атомами внутри глобулы белка. Участвующие в контакте аминокислотные остатки - Ser117 и Glu101. Между ними образуются две водородные связи длиной 2.9 и 2.8 Å.
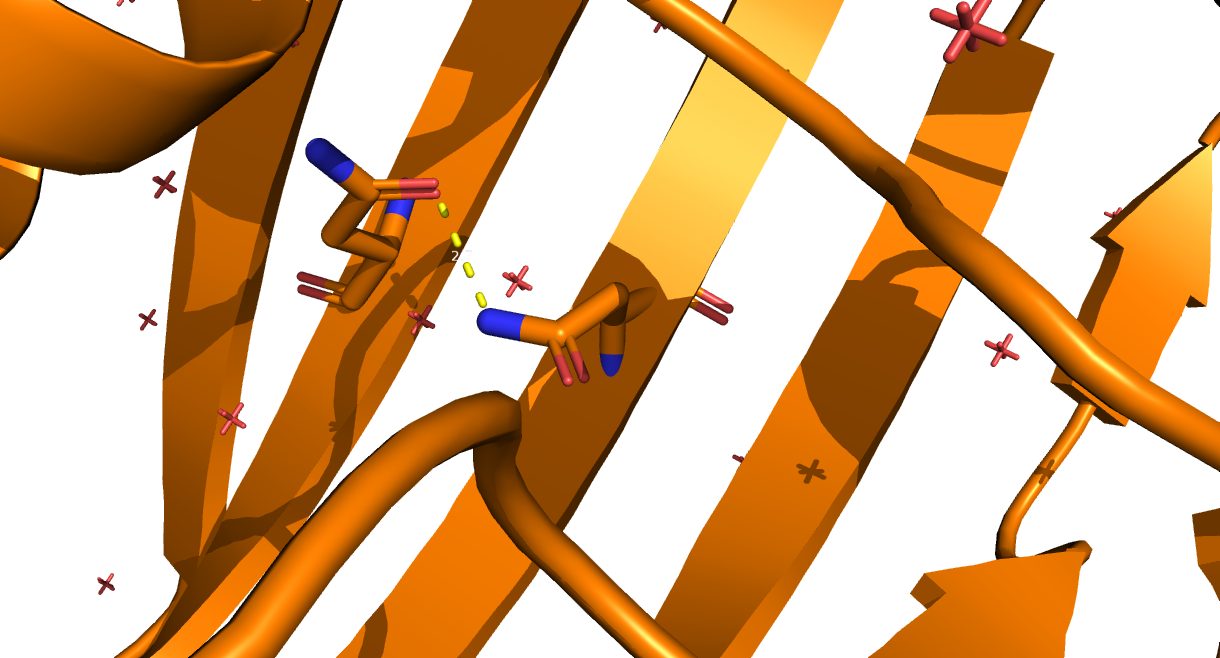
Рис. 4. Водородные связи между боковыми цепями в ядре белка. Участвующие в контакте аминокислотные остатки - Asn100 и Asn118. Между ними образуется водородная связь длиной 2.7 Å.
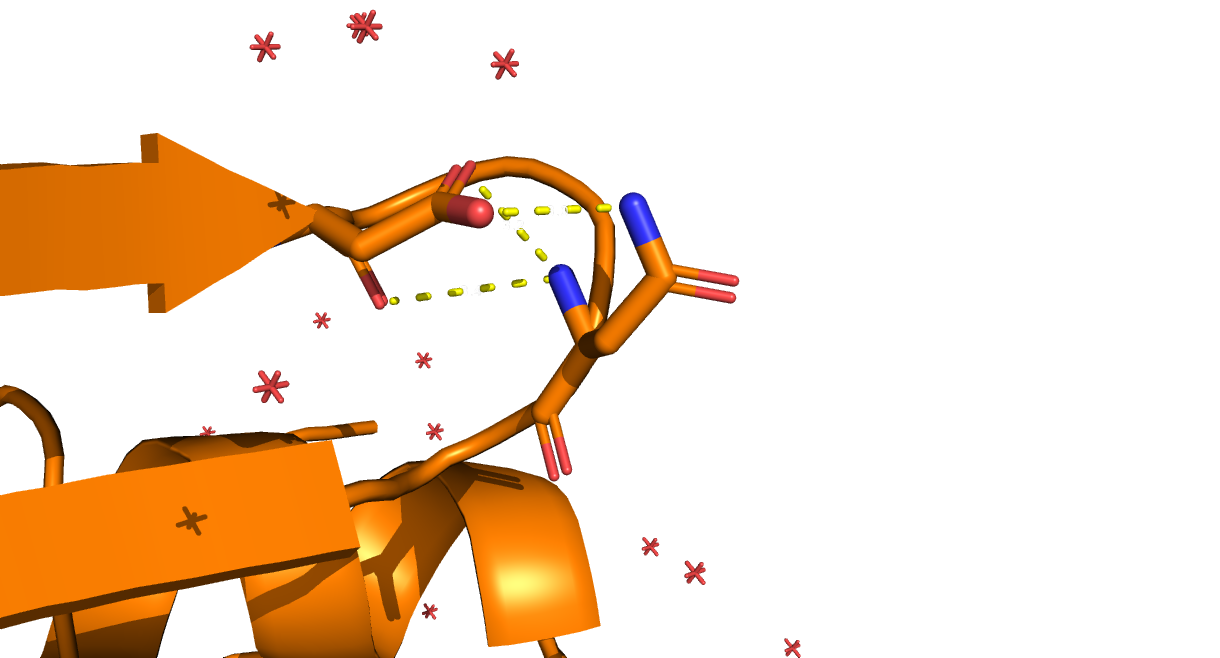
Рис. 5. Водородные связи в петлях, выходящих на поверхность глобулы. Участвующие в контакте аминокислотные остатки - Asn78 и Asp75. Между ними образуются три водородные связи длиной 3.0, 3.2 и 3.4 Å.
Таблица 1. Сравнение водородных связей в ЯМР и РСА моделях.
| Водородная связь | РСА | ЯМР | |||
|---|---|---|---|---|---|
| d, Å | W, % | dmin, Å | dmax, Å | dmean, Å | |
| Ser117/N и Glu101/O | 2.8 | 100 | 1.7 | 2.3 | 1.82 |
| Ser117/O и Glu101/N | 2.9 | 100 | 1.6 | 2.1 | 1.86 |
| Asn100/ND2 и Asn118/OD1 | 2.7 | 26.1 | 2.2 | 2.8 | 2.48 |
| Asn78/ND2 и Asn75/OD2 | 3.0 | 0 | - | - | - |
| Asn78/N и Asp75/OD1 | 3.2 | 8.7 | 1.9 | 2.1 | 2.0 |
| Asn78/N и Asp75/O | 3.4 | 0 | - | - | - |
Водородные связи между атомами в остове белка, в бета-листе (между Ser117 и Glu101) очень стабильны и встречаются в 100% ЯМР-моделей, потому что остатки внутри глобулы стабильны и неподвижны. Однако связи в ЯМР-структуре кроче, чем в структуре, полученной методом РСА. Водородные связи боковых цепей в ядре белка недостаточно стабильные (между Asn100 и Asn118), а водородные связи в петлях, выходящих на поверхность глобулы (между Asn78 и Asp75), совсем нестабильны, так как петли очень подвижны.