Задание 1
Мне достались PDB ID 5SAN (разрешение 0.94 Å) и 3URI (разрешение 2.10 Å). Это структуры эндотиапепсина — аспартатной протеазы из аскомицета Cryphonectria parasitica.
Если открыть эти структуры в PyMOL, сразу бросается в глаза, что в структуре 3URI есть какие-то обрывки цепи (см. Рис. 1).
Более того, если с помощью mesh смотреть на структуры в целом, сразу становится очевидно, что разрешение структуры 5SAN заметно выше. В качестве примера можно взглянуть на фрагмент остова с 233 по 239 остатки структуры 3URI и соответствующий ему фрагмент 234 по 240 а.о. структуры 5SAN (Рис. 2).
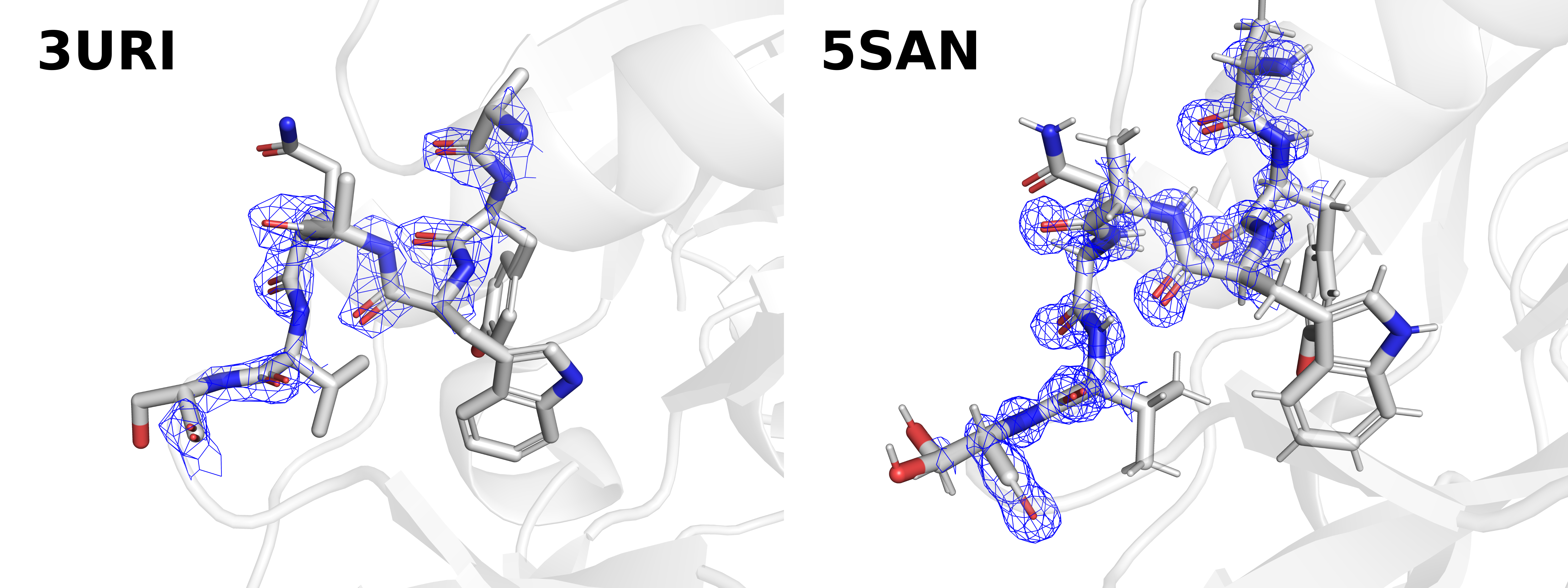
Если в случае 5SAN четко видны сферы, соответствующие высокой плотности электронов на отдельных атомах, электронная плотность структуры 3URI только приблизительно очерчивает атомы остова. Более того, мы видим разрыв плотности в структуре 3URI на аланине-236.
Таким образом, более низкое разрешение структуры 3URI заметно даже при первом взгляде и подтверждается при более детальном рассмотрении.
Задание 2
В этом и следующем задании я рассматривал структуру 5S9Q — бромодомен из BRD4 — хроматинсвязывающего белка, узнающего ацетилированный лизин в составе гистонов.
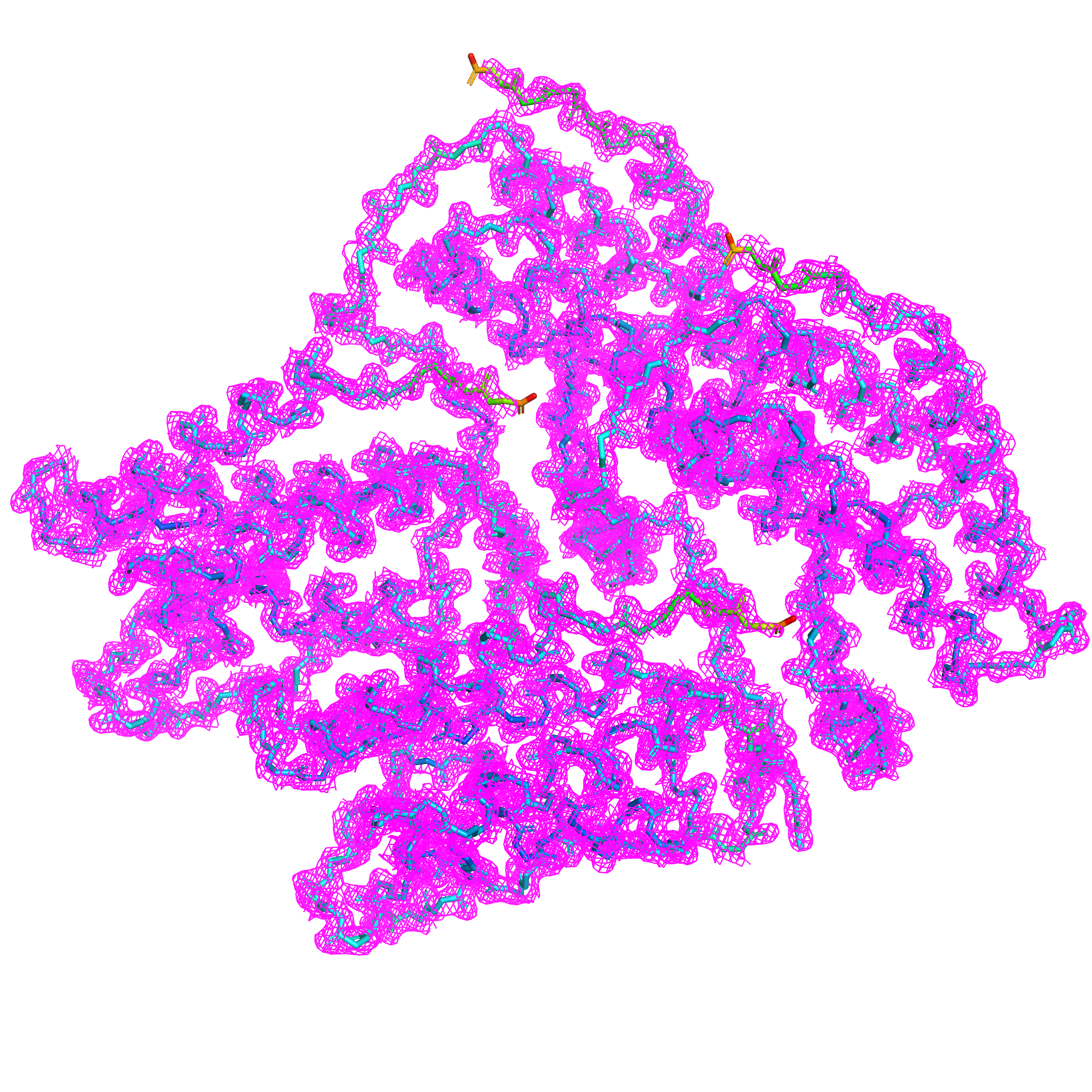
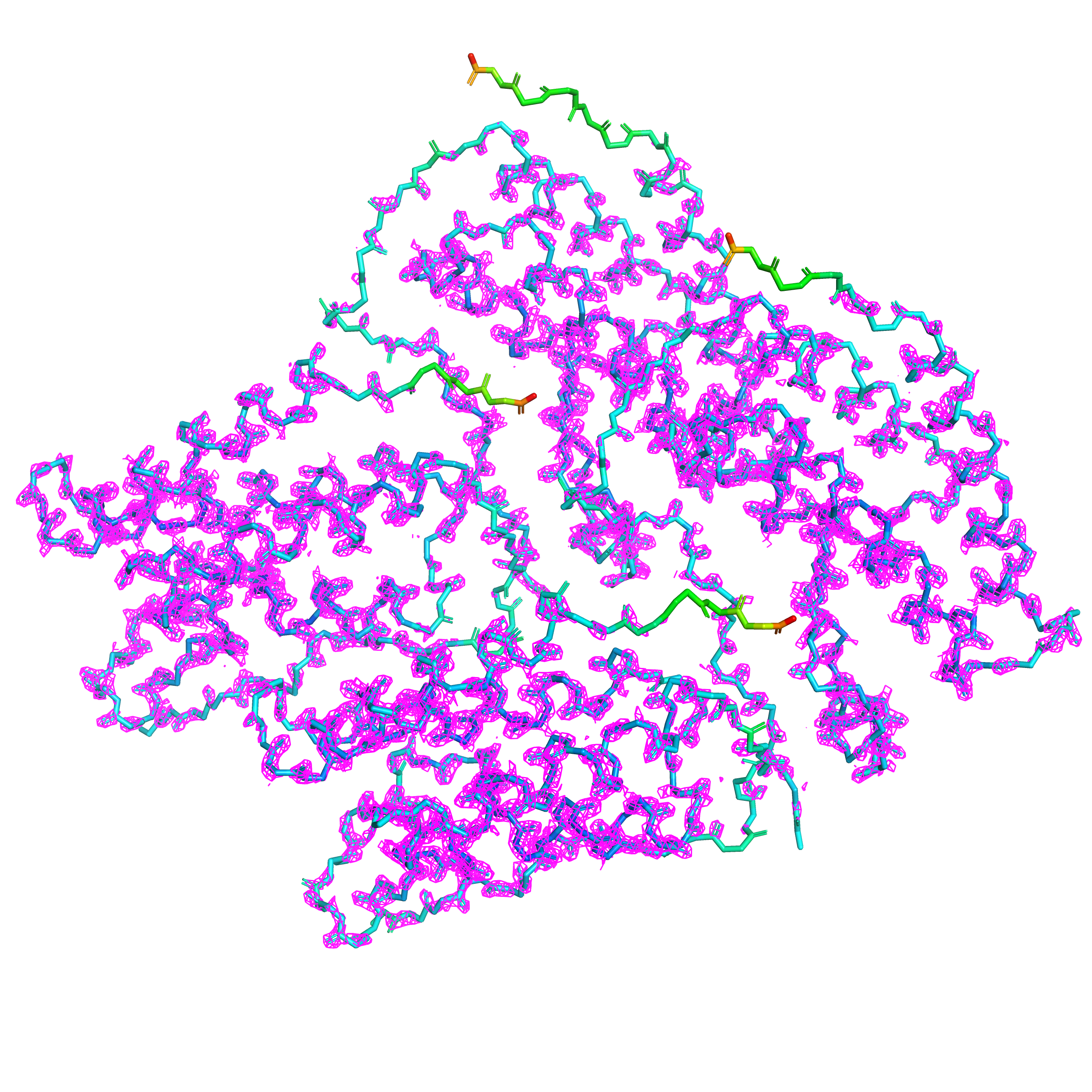
При отображении электронной плотности остова данной структуры на различном уровне подрезки мы наблюдаем, естественно, очень разный объем, покрытый поверхностью сетки (Рис. 3-5). Видно, что чем выше B-фактор, что соответствует высокой степени подвижности, тем меньше плотность электронной плотности и тем быстрее сетка исчезает при увеличении уровня подрезки.
4 участка с наиболее высоким B-фактором, плохо покрытых сеткой даже на уровне подрезки 1, — это C-концы всех четырех цепей данного белка.

Задание 3
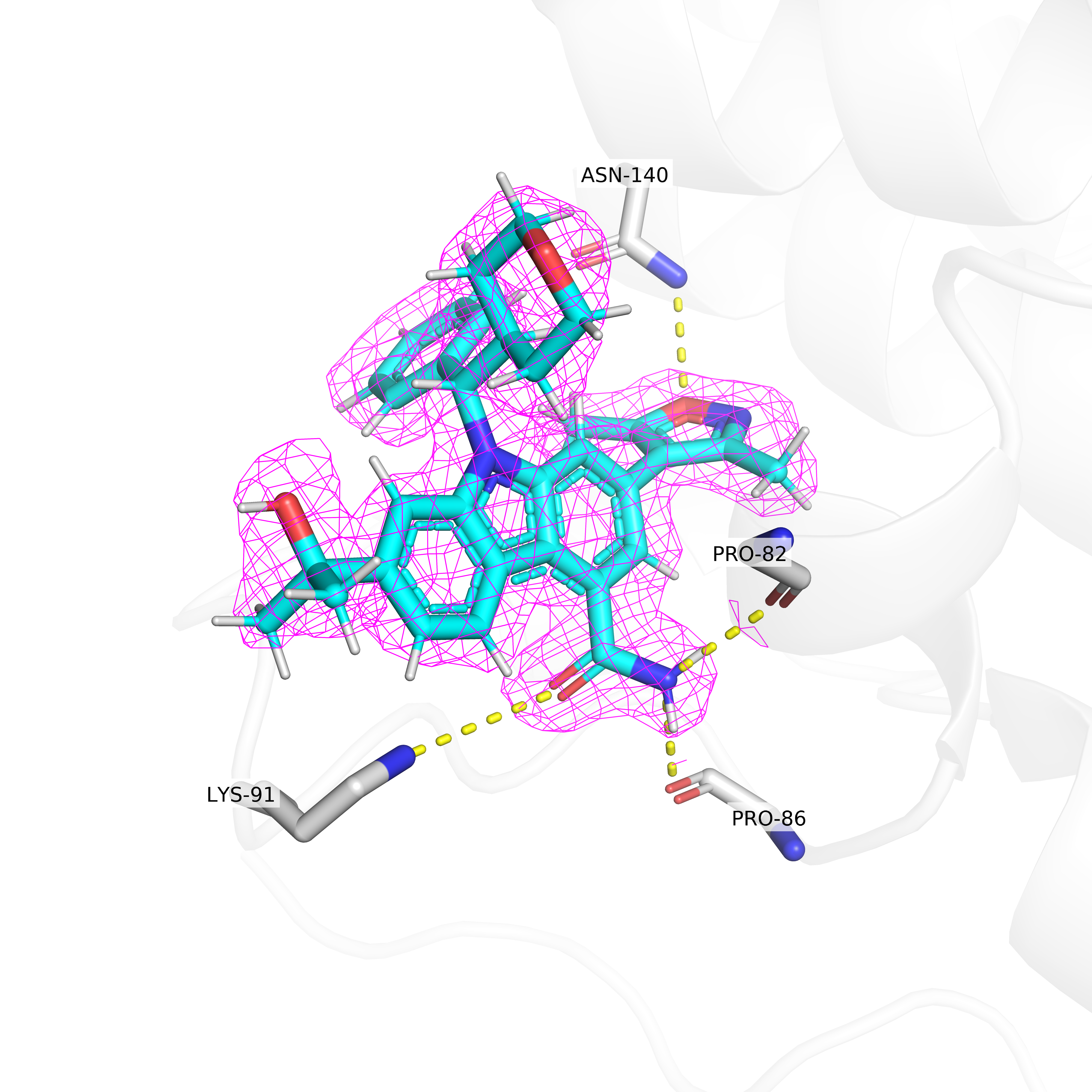
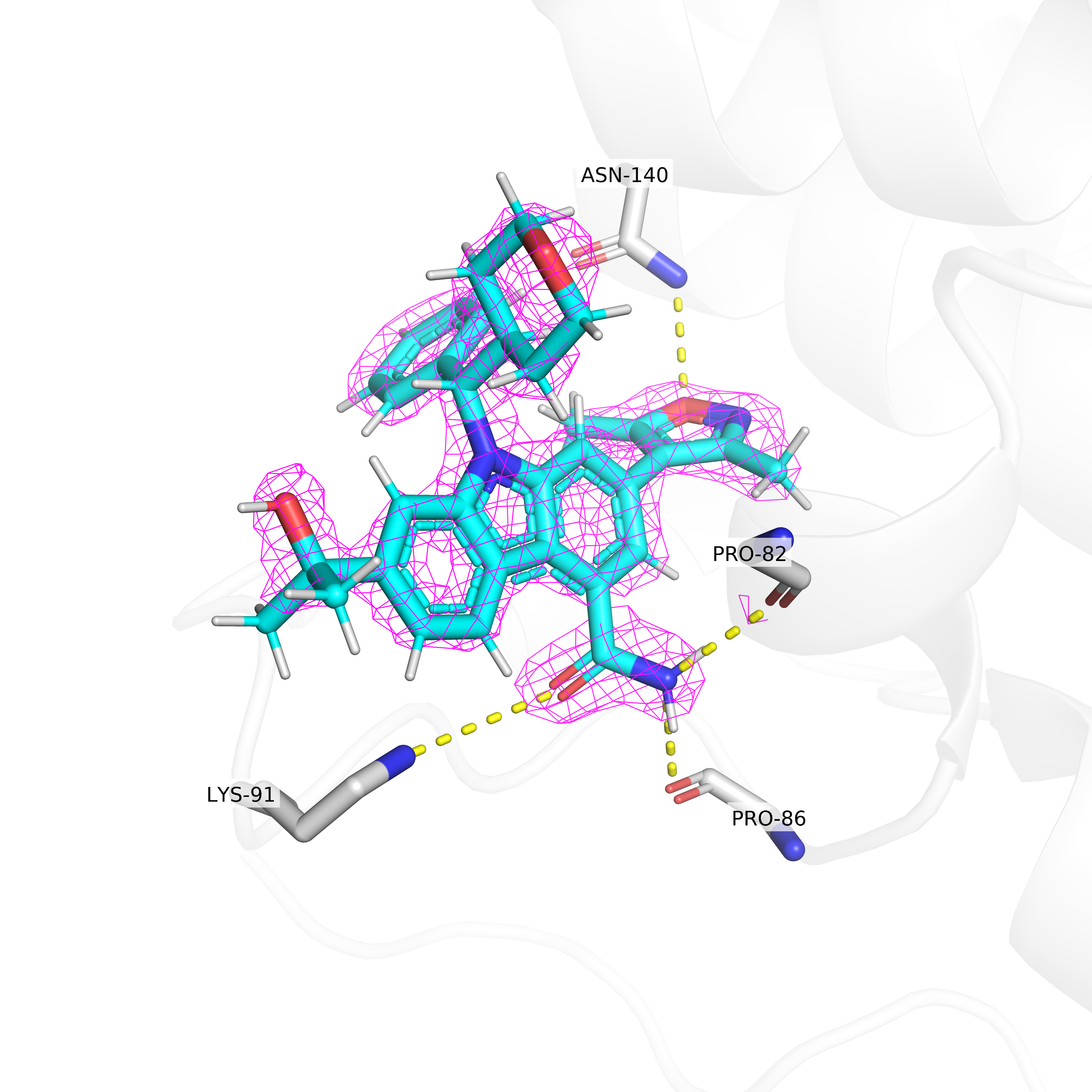
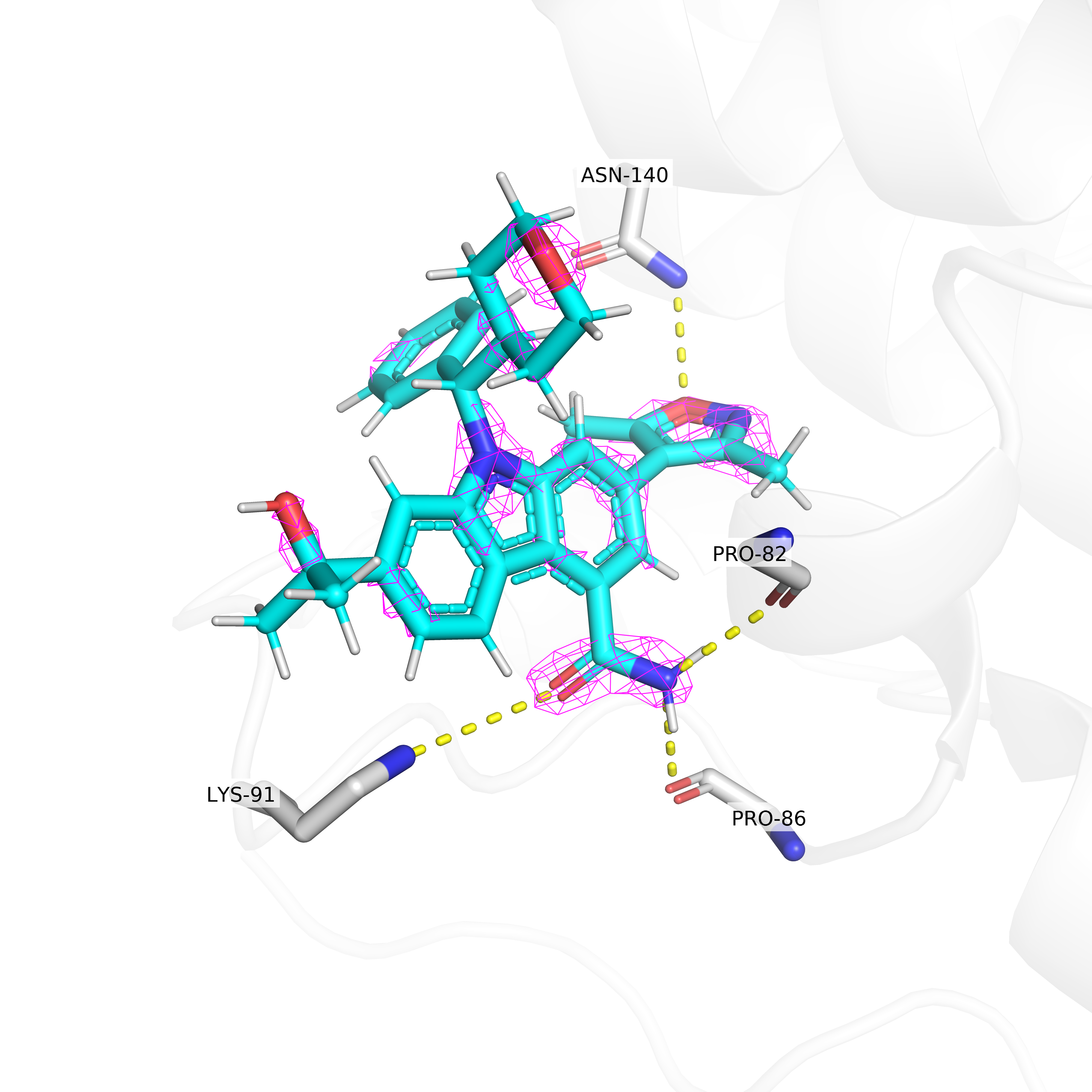
В данном задании я рассматривал электронную плотность вокруг лиганда структуры 5S9Q, а именно ингибитора данного белка. Из Рис. 6-8 видно, что на уровне подрезке 3 остаются покрытыми электронной плотностью только некоторые части лиганда. Можно предположить, что эти участки важны для связывания лиганда с бромодоменом.
Для некоторых из этих участков данное предположение легко подтвердить: на рисунках показаны предположительные водородные связи лиганда с белком. Так, изоксазольное кольцо лиганда может образовывать водородную связь с остатком аспарагина-140, а амидная группа - сразу с лизином-91, пролином-86 и пролином-82.