Задание 1. Разметка вторичной структуры в ручном режиме
В этом задании мы работали со структурой 1KJQ - глицинамидрибонуклеотидтрансформилазой из Escherichia coli, подробное описание которой доступно в отчете по шестому практикуму по ссылке.
Авторы данной структуры самостоятельно разметили для нее элементы вторичной структуры, и именно эту разметку можно наблюдать на рисунках из шестого практикума. Однако ничего не мешает нам самостоятельно разметить вторичную структуру, пользуясь сервисом 2Struc, который позволяет для этой цели применять такие алгоритмы, как DSSP, STRIDE и P-SEA. Первые два алгоритма сперва разными способами находят водородные связи, а затем ищут паттерны этих связей, характерные для различных типов вторичной структуры (STRIDE при этом также учитывает карты Рамачандрана). Алгоритм P-SEA для разметки пользуется только информацией о положении C-альфа атомов. На рис. 1 изображена сводная таблица из 2Struc с информацией о долях разных элементов вторичной структуры в цепи А в соответствии с разметкой разных алгоритмов.
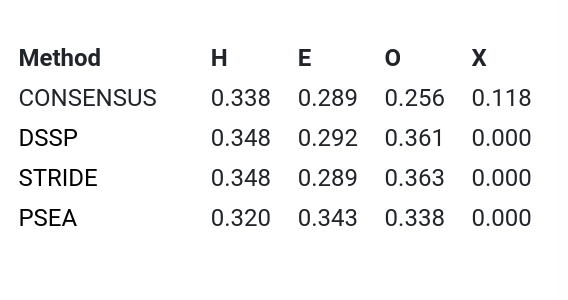
Если судить по данной таблице, DSSP и STRIDE дают очень похожие результаты, в то время как PSEA сильно больше остатков включает в состав бета-листов. Это неудивительно, если учитывать, что DSSP и STRIDE для разметки бета-листа необходимо наличие соответствующих водородных связей между бета-стрендами, а PSEA судит исключительно по положению C-альфа атомов в предполагаемом бета-стренде.
На рис. 2 показан фрагмент цепи А данной структуры, в пределах которого есть сразу три участка, разметка вторичной структуры для которых разными алгоритмами различается. Стоит сказать, что это обращенный в растворитель фрагмент домена B данного белка (см. рис. 7 отчета по практикуму 6), для которого в практикуме 6 было показано наихудшее покрытие электронной плотностью (см. рис. 6 и 9 там же).
Во-первых, остаток 113 и авторы структуры, и алгоритм PSEA отнесли к спирали, в то время как DSSP - к изгибу (bend), а STRIDE - к витку/иному типу (coil/other). При взгляде на структуру (рис. 2) сразу очевидно, что никакой альфа- или какой-либо иной спирали в этом месте быть не может, поскольку тут действительно происходит резкий изгиб, как и разметил DSSP.
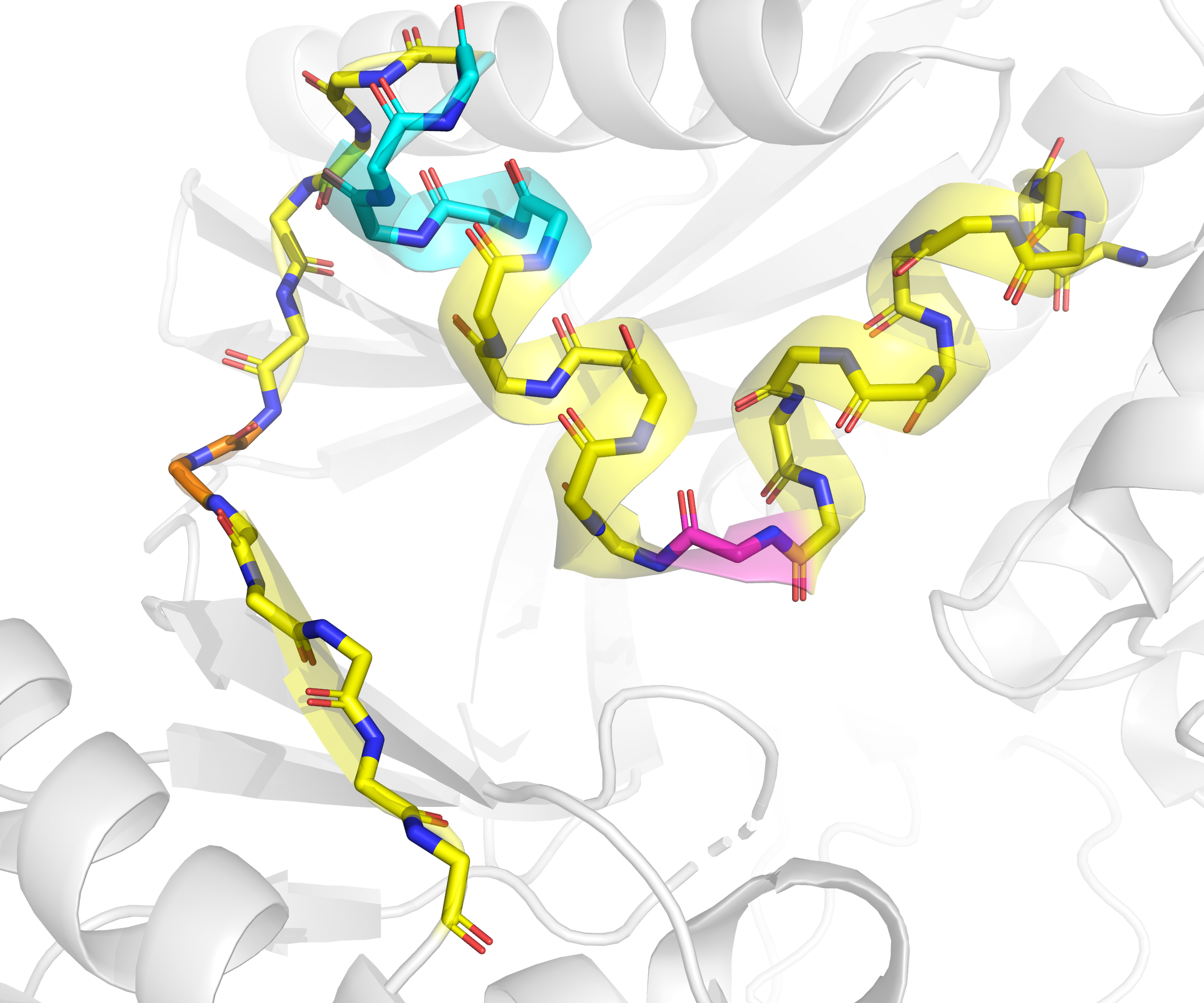
Во-вторых, между разметками всех трех алгоритмов есть различия на участке со 120го по 126ой остаток (см. рис. 3): PSEA прекращает спираль на остатке аланина-121, STRIDE - на остатке глутаминовой кислоты-123 и дальше с 124 по 126 остаток размечает как поворот, а DSSP размечает остатки 120-124 как пи-спираль, а остаток 125 - как изгиб (bend).
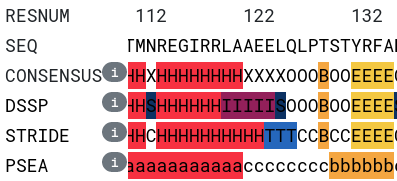
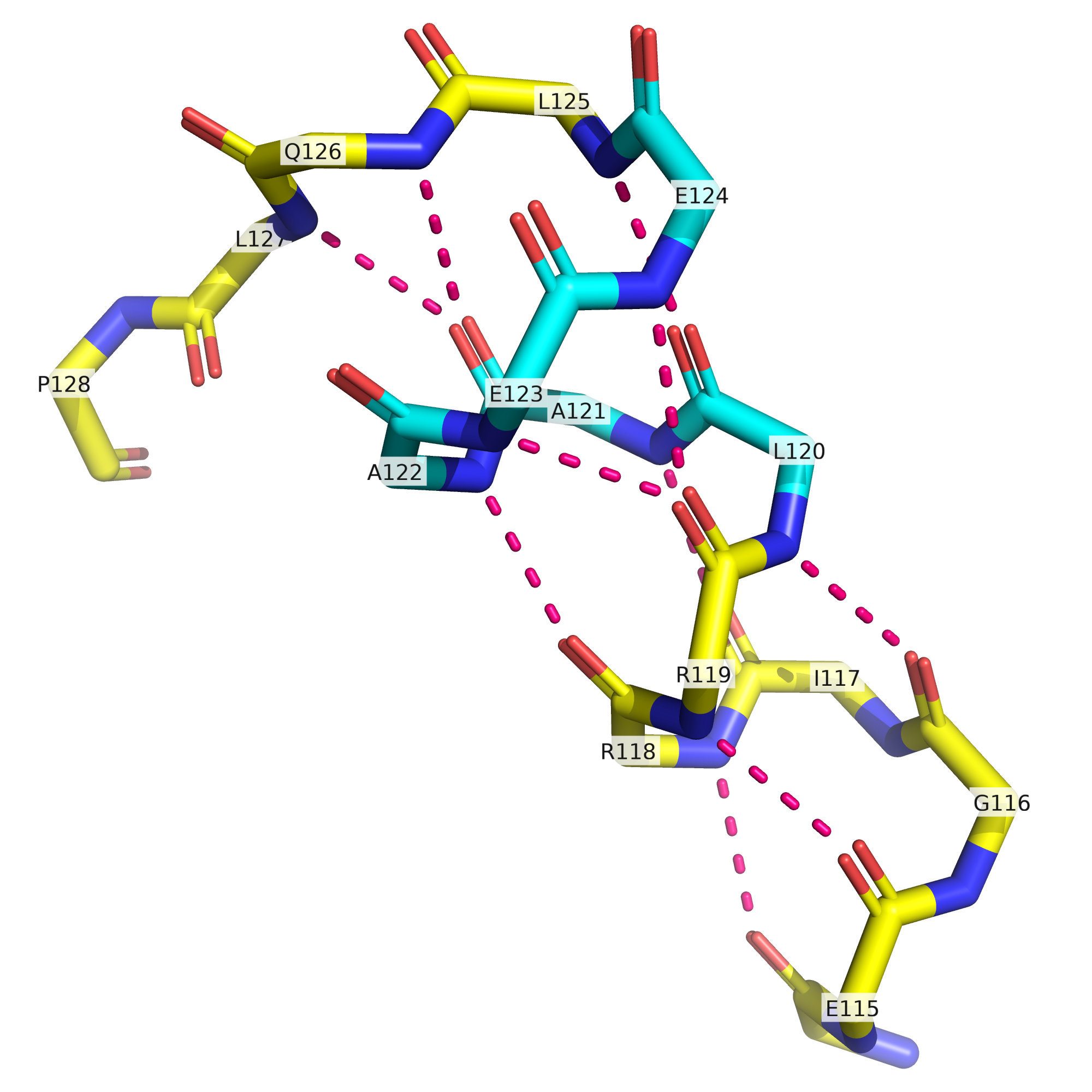
На рис. 4 показан участок со 114 по 128 остатки, и положение кислородов и азотов остова свидетельствует, что карбонильные группы остатков со 119го по 121й могут образовывать водородные связи с NH2-группами остатков, отстающих от них на пять позиций, а значит остатки 120-124 действительно разумно разметить как 516 пи-спираль. Алгоритм PSEA по идее должен допускать для спиралей в том числе пи-конфигурацию, однако все же прекращает спираль на 121ом остатке, что точно не соответствует имеющейся структуре. В то же время, разметка STRIDE с прекращением альфа-спирали на остатке 123 и поворотом на остатках 124-126 сама по себе вполне валидна, однако упускает содержащуюся в данной структуре информацию о конфигурации этих самых остатков 124-126, способных не просто служить поворотом, но и образовывать водородные связи с предыдущими остатками характерным для пи-спирали образом.
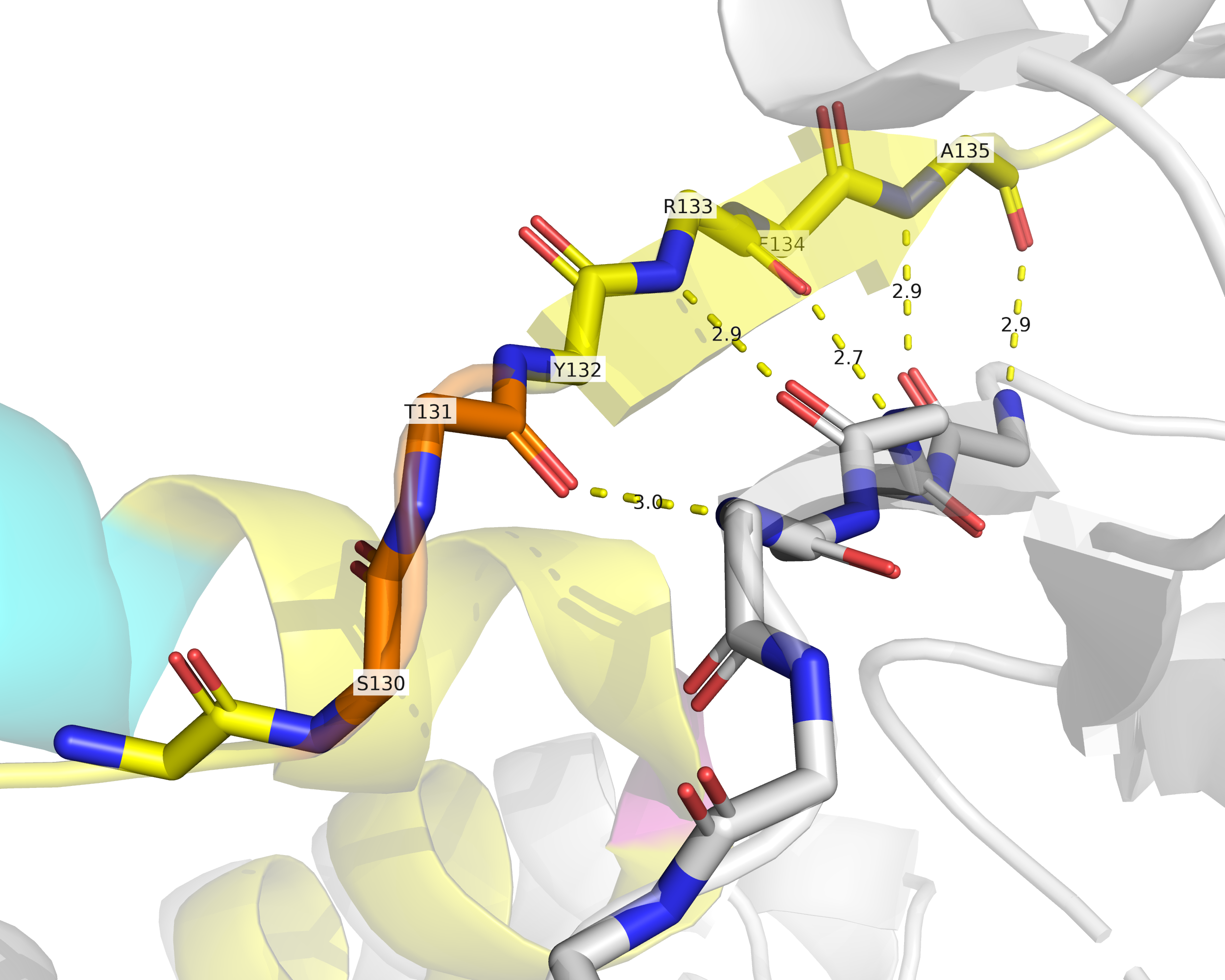
PSEA, как видно из рис. 3, размечает остатки 130-131 как бета-лист, что, однако, не подтверждается имеющимися данными: на рис. 5 изображен соответствующий фрагмент остова, а также находящийся рядом другой участок, вместе с которым они, судя по всему, образуют бета-лист. Нетрудно заметить, что серин-130 совершенно точно не являются частью бета-листа, а треонин попадает в бета-лист разве только наполовину, т.к. его NH2-группа обращена в растворитель, в то время как карбонильная группа и правда может образовывать водородную связь с другим участком белка.
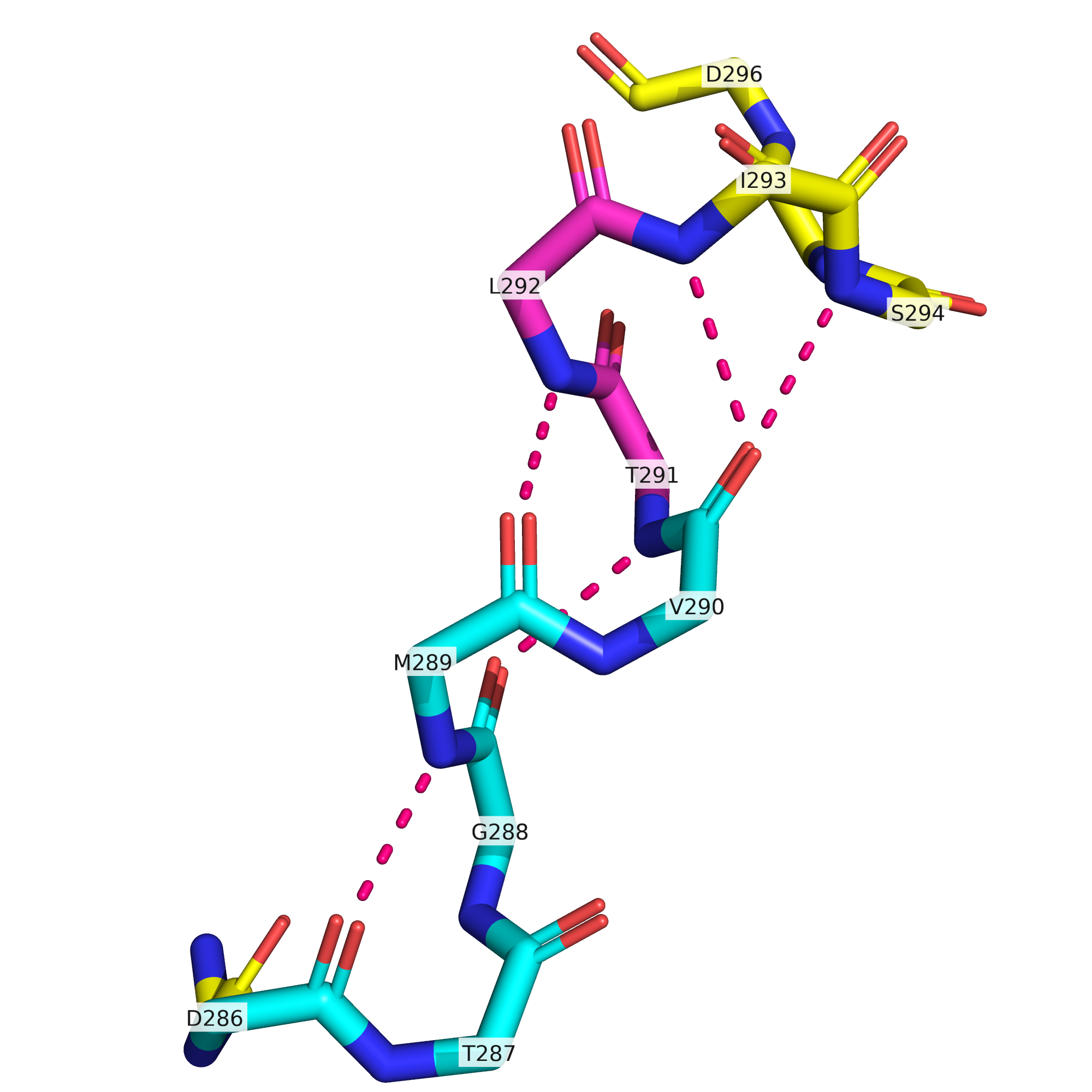
В этом белке есть и другой участок, для которого разные алгоритмы дают заметно разную разметку вторичной структуры. Это участок с 291 по 294 остатки, показанный на рис. 6. Ему предшествуют пять остатков, размеченных и DSSP, и STRIDE как 310-спираль. При этом DSSP разметил остатки 291-294 как альфа-спираль, а STRIDE разметил остатки 291-292 как 310-спираль, а 293-294 - как поворот. Остаток 295 они оба разметили как бета-мостик. PSEA весь этот участок не разметил никак.
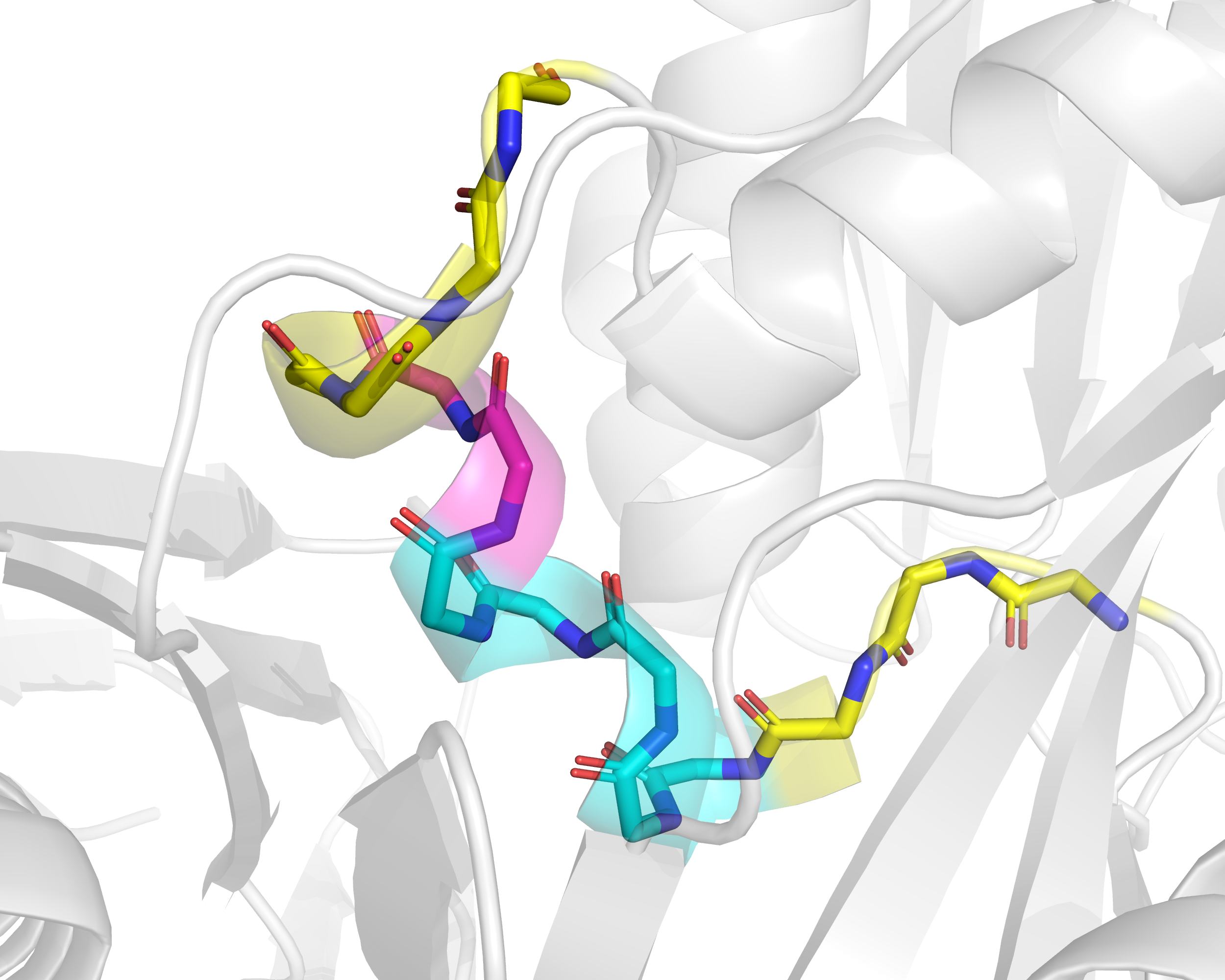
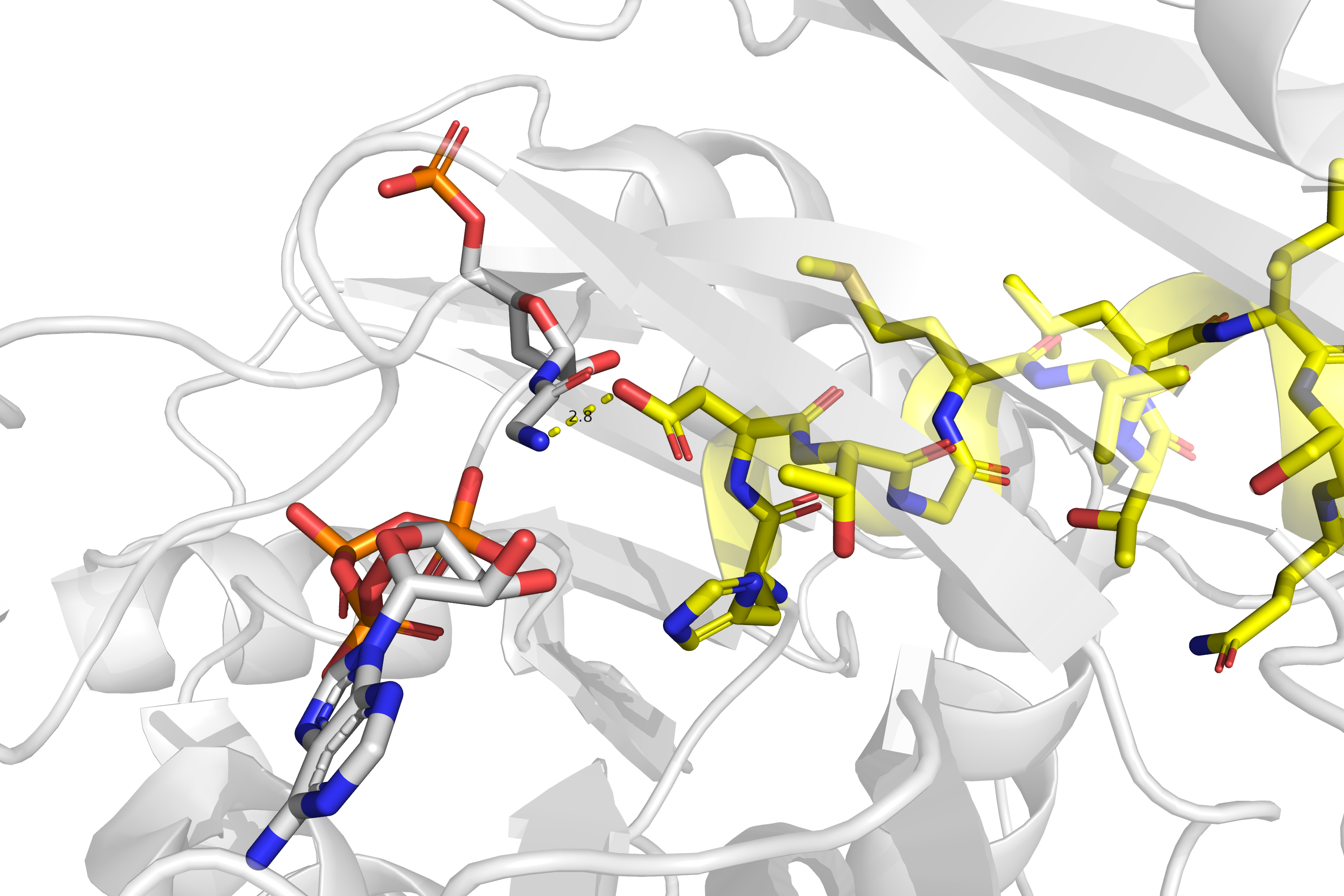
Стоит сказать, что это участок, в отличие от рассматривавшегося нами выше, находится в ядре белка и, по-видимому, чрезвычайно важен функционально, т.к. на N-конце данной спирали смыкаются сайты связывания АТФ (вместе с Mg2+) и глицинамидрибонуклеотида (субстрата данного фермента). На рис. 7 показан данный участок в структуре 1KJ8 - это структура из той же статьи, что и рассматриваемая нами 1KJQ, но в 1KJ8 фермент связан одновременно с АТФ и с субстратом, а не только с АДФ. Остаток аспарагиновой кислоты-286 связывает NH2-группу субстрата, а гистидин и NH2-группы данного участка цепи, по-видимому, играют роль в связывании фосфатной группы АТФ и в осуществлении катализируемой реакции. В нашей структуре 1KJQ остов данного участка цепи очень хорошо покрыт сеткой электронной плотности (рис. 8).
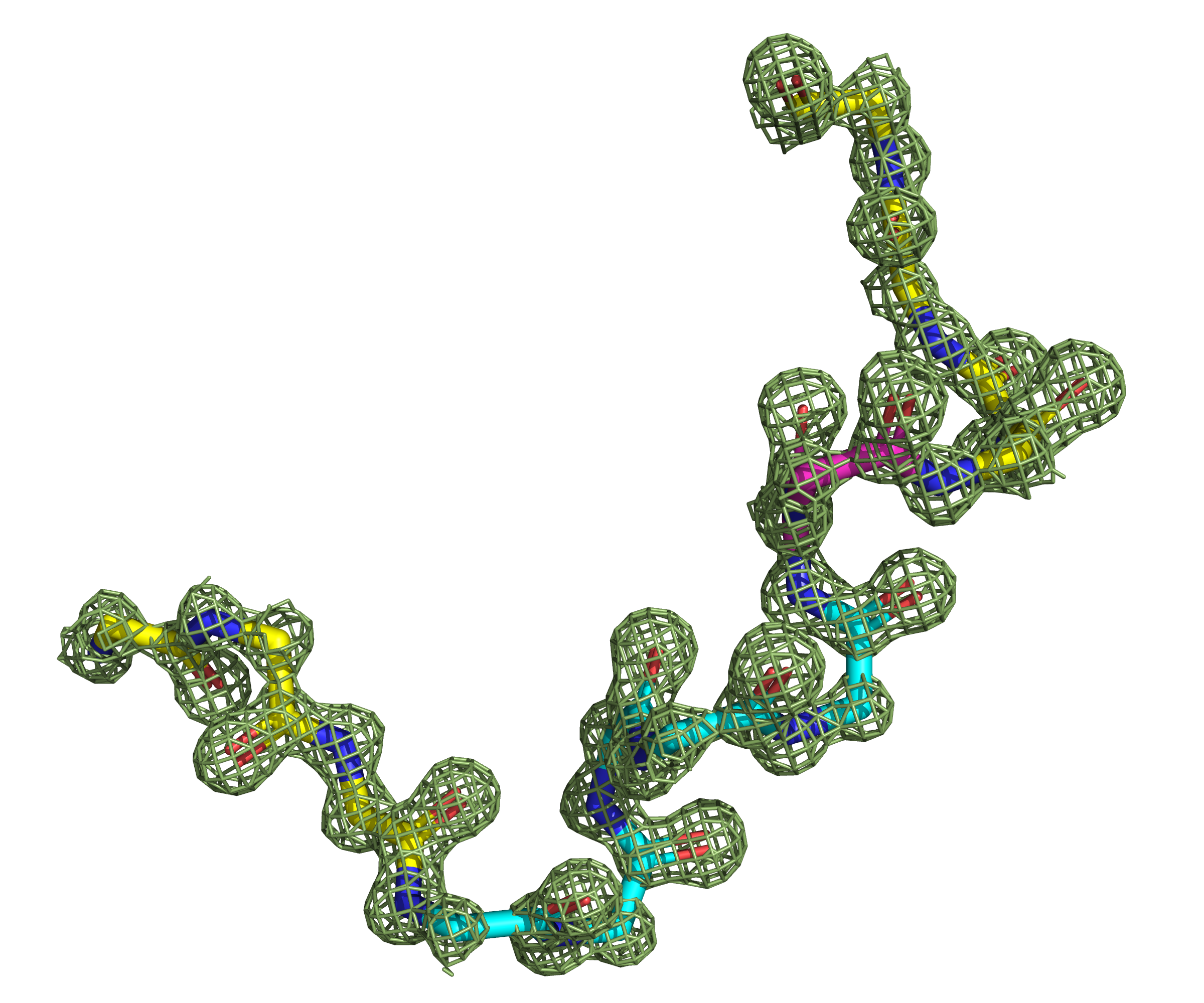
Поскольку данный участок функционально значимый, само наличие здесь 310-спирали не должно нас удивлять. Однако при ближайшем рассмотрении оказывается, что и эта спираль тут не совем уж хорошо прослеживается. Как видно из рис. 9, карбонильная группа остатка 286 действительно может образовывать водородную связь с NH2-группой 289го остатка (как и положено в 310-спирали), однако карбонильная группа 287го остатка смотрит в сторону и находится на относительно большом расстоянии от NH2-группы остатка 290. Что касается карбонильных групп остатков 288 и 289 и их водородных связей, они вполне однозначно указывают на наличие пусть и не идеальной, но все же 310-спирали. А вот остаток 290 своей карбонильной группой может образовывать водородную связь с NH2-группой как 293го, так и 294го остатка. Осмелюсь предположить, что поскольку приоритет альфа-спирали в DSSP выше, чем 310-спирали, данный алгоритм размечает этот небольшой участок как альфа-спираль. В то же время, STRIDE, основанный на knowledge-based вероятностях разных структур по картам Рамачандрана, обозначает остатки 291 и 292 как продолжение все той же 310-спирали. В целом, рассматривать остатки 286-292 как одну 310-спираль, а 293-294 - как поворот, как делает STRIDE, в этом месте кажется более разумным, чем относить остатки 286-290 к 310-спирали, а 291-294 к альфа-спирали, как делает DSSP.
Задание 2. Разметка вторичной структуры в автоматическом режиме
В данном задании для выборки из 30 структур PDB мы рассчитали, насколько разные аминокислоты склонны образовывать различные элементы вторичной структуры: альфа-спирали, бета-листы или что-либо другое.
Скрипт на питоне, написанный мной для выполнения данного задания, вы можете скачать. Этот скрипт выдает таблицу в формате html, которую вы можете видеть ниже.
Propensity аминокислотных остатков (их склонность образовывать те или иные элементы вторичной структуры) было рассчитано по формуле P_ik = (n_ik/n_i) / (N_k/N), где P_ik - это propensity аминокислотного остатка i образовывать тип вторичной структуры j, n_ik - это количество остатков i в датасете, образующих тип вторичной структуры j, n_i - это общее количество остатков i в датасете, N_k - это общее количество остатков, образующих тип вторичной структуры j во всем датасете, а N - это общее количество остатков в датасете.
| Helix | Sheet | Other | |
|---|---|---|---|
| C | 0.81 | 0.77 | 1.22 |
| S | 0.77 | 0.87 | 1.22 |
| M | 1.43 | 0.50 | 0.88 |
| A | 1.54 | 0.74 | 0.71 |
| P | 0.42 | 0.34 | 1.68 |
| T | 0.70 | 1.21 | 1.14 |
| Y | 0.96 | 1.74 | 0.74 |
| E | 1.29 | 0.68 | 0.91 |
| R | 1.44 | 0.97 | 0.69 |
| V | 0.87 | 1.98 | 0.71 |
| D | 0.75 | 0.43 | 1.40 |
| W | 1.24 | 1.28 | 0.72 |
| G | 0.36 | 0.62 | 1.61 |
| I | 0.92 | 1.84 | 0.73 |
| L | 1.31 | 1.27 | 0.67 |
| K | 1.01 | 0.84 | 1.05 |
| F | 1.03 | 1.49 | 0.79 |
| N | 0.66 | 0.75 | 1.34 |
| Q | 1.38 | 0.67 | 0.85 |
| H | 0.82 | 0.89 | 1.17 |
Из этой таблицы можно заключить, например, что в данной выборке структур метионин, аланин и глутамин заметно чаще образуют альфа-спирали, чем бета-листы и петли, а валин, изолейцин и тирозин заметно чаще образуют бета-листы, чем альфа-спирали и петли. В то же время, и это совсем уж ожидаемый результат, пролин и глицин заметно чаще образуют петли, чем альфа-спирали и бета-листы.