Задание 1. Альтернативные положения
Мне достался PDB ID 7AOT — FK506 binding protein 51 (FKBP51) — регулятор сигналинга через рецепторы глюкокортикоидов.
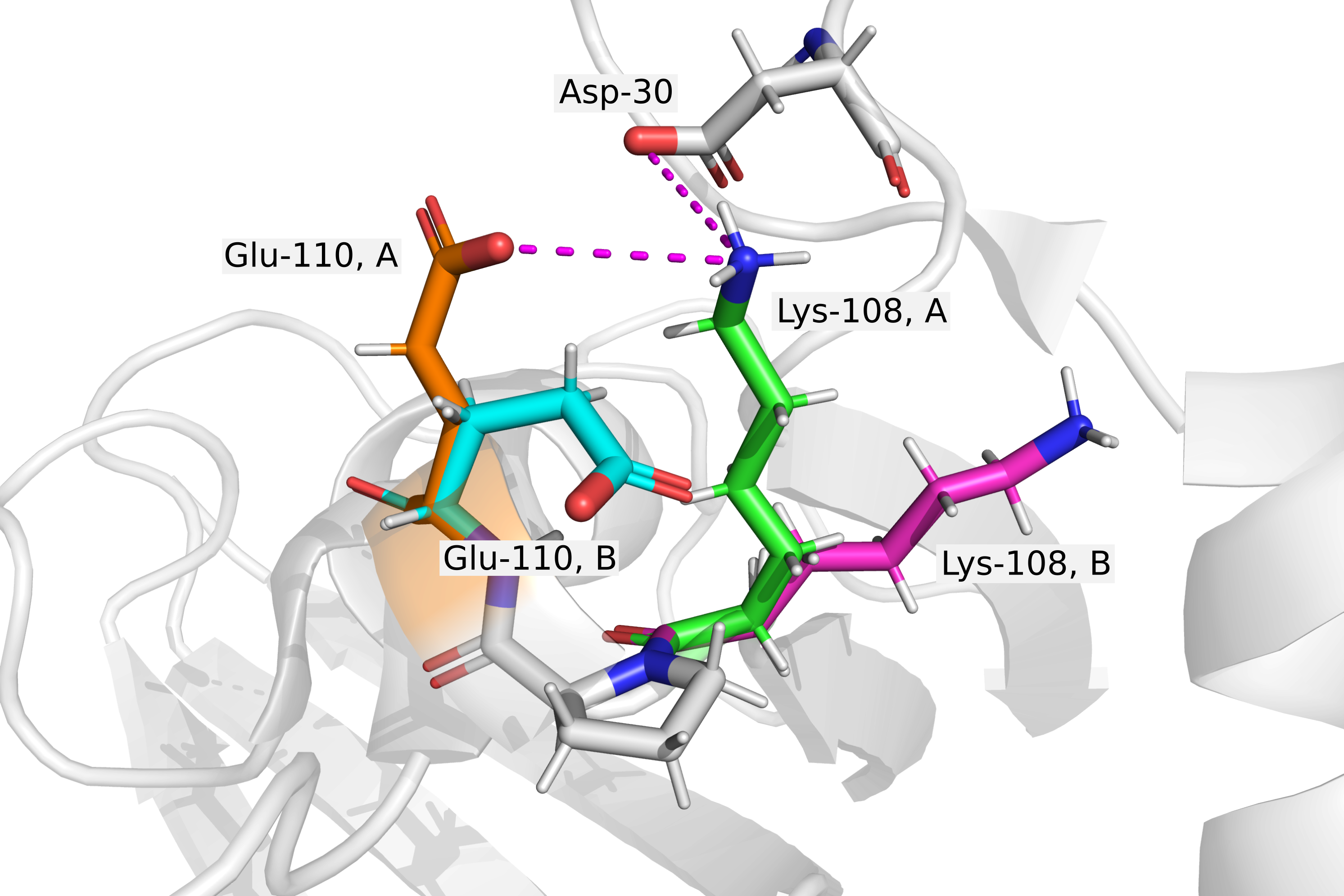
В первом задании я рассматривал альтернативные положения двух аминокислотных остатков: глутаминовой кислоты-110 и лизина-108 (Рис. 1). На рисунке разными цветами обозначены A- и B-положения данных остатков. Вероятно, положение A остатка глутамата-110 соответствует положению A остатка лизина-108, т.к. в такой конформации между ними может образовываться соляной мостик (хотя расстояние равно 4 ангстрема, что достаточно много). Кроме того, в положении A лизина он может стабилизироваться солевым мостиком с аспартатом-30, однако там расстояние даже чуть больше 4 ангстрем.
Единственная совершенно невозможная комбинация положений данных двух остатков - это глутамат в положении B и лизин в положении A, т.к. в таком случае глутамат оказывается очень сильно приближен к лизину, причем заряженной группой к гидрофобной цепочке.
Задание 2. B-фактор
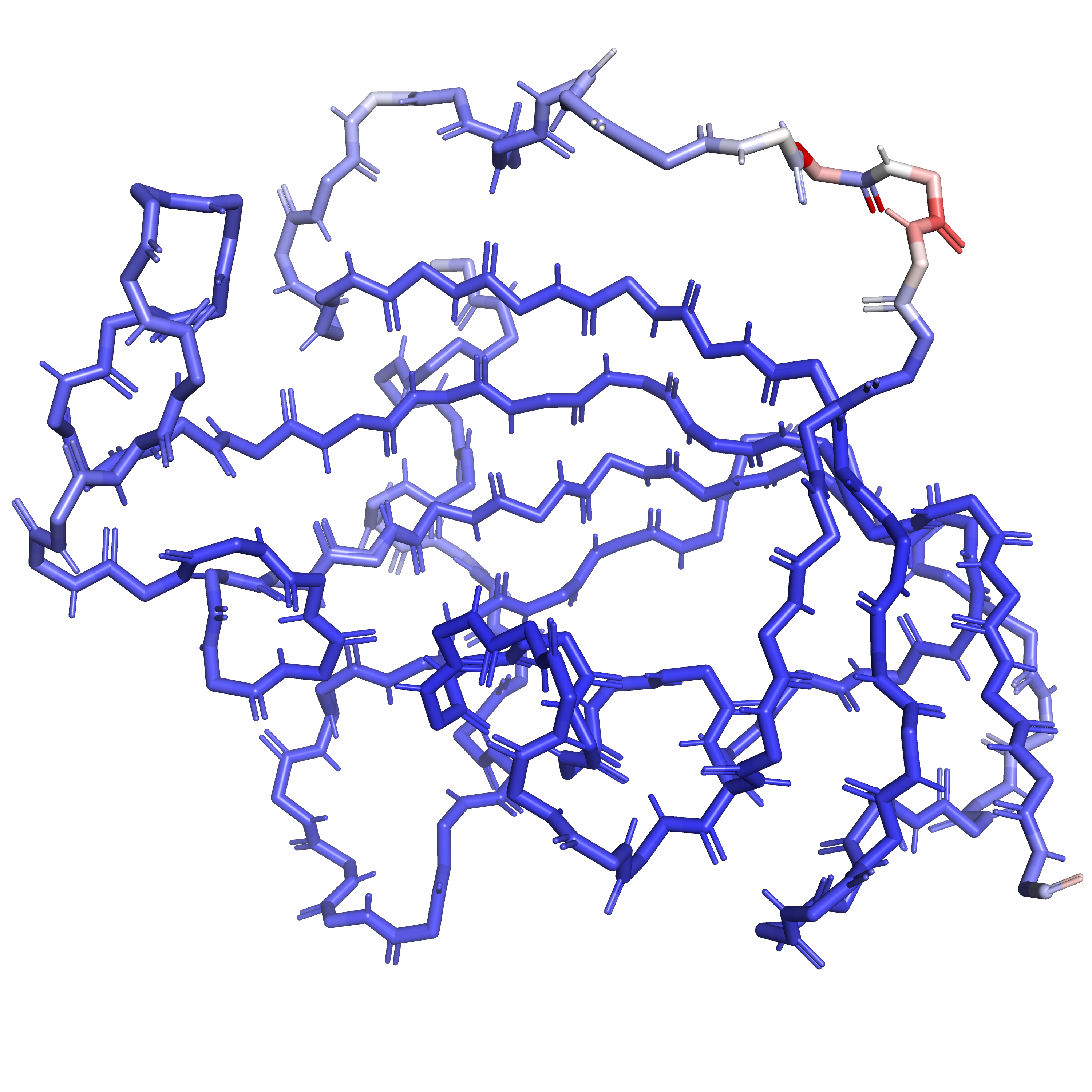
В данном задании мной изучался B-фактор атомов структуры 7AOT. Чем выше B-фактор, тем выше подвижность атома. На Рис. 2 представлен остов всей структуры целиком, раскрашенный по B-фактору. Мы видим, что есть один небольшой участок остова, где B-фактор особенно высок. Что ожидаемо, данный участок находится в выпетливании на поверхности белка и не входит в состав альфа-спирали или бета-листа.
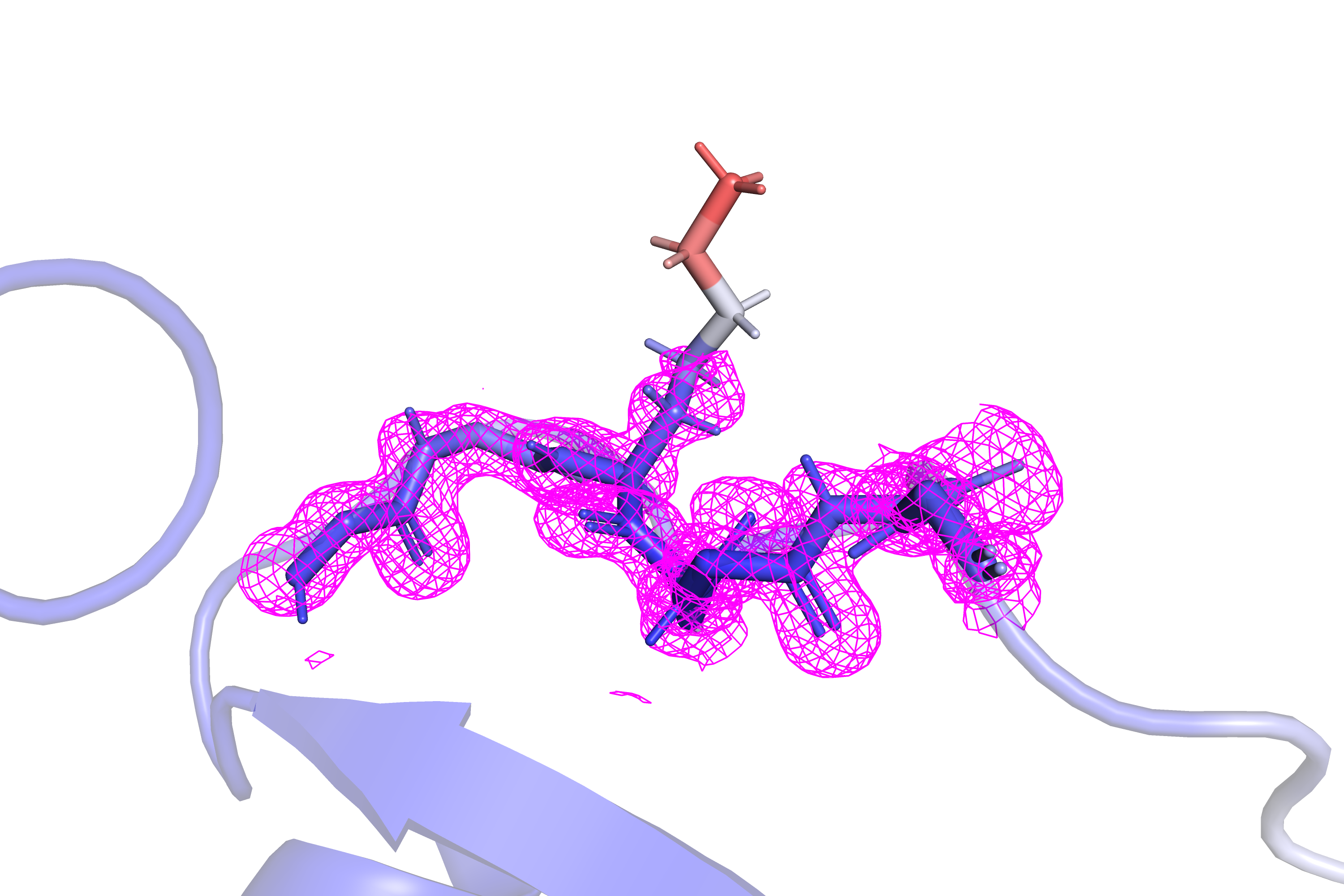
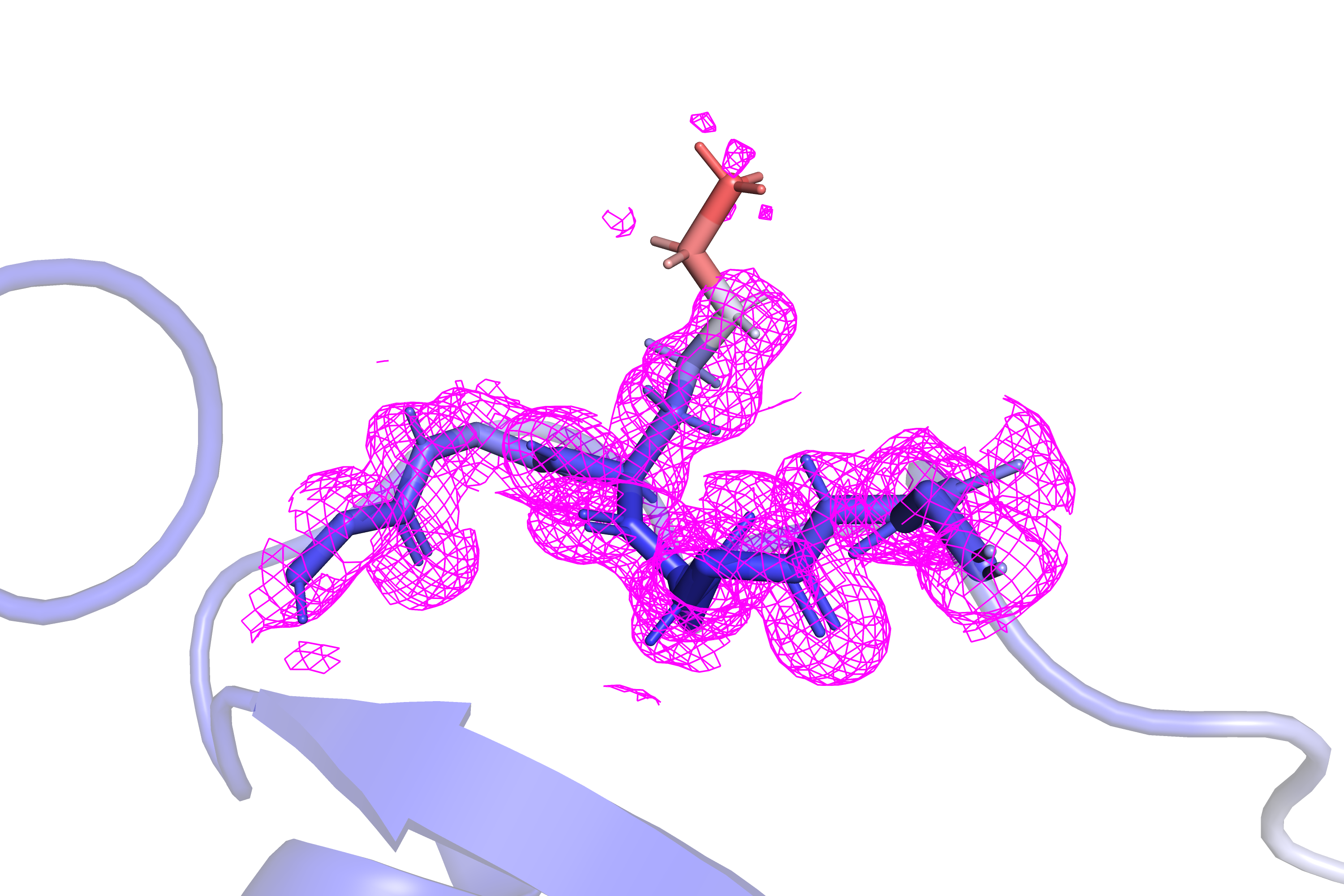
На рисунках 3 и 4 показан лизин-66 данного белка, боковая цепь которого обладает особенно высоким B-фактором. И даже при довольно низких значениях уровня подрезки электронной плотности (1 или 0.4) сетка mesh даже близко не покрывает данную боковую цепь полностью. Очевидно, данный остаток сильно подвижен в растворе либо из-за расположения на поверхности как-то по-разному может вести себя при кристаллизации.
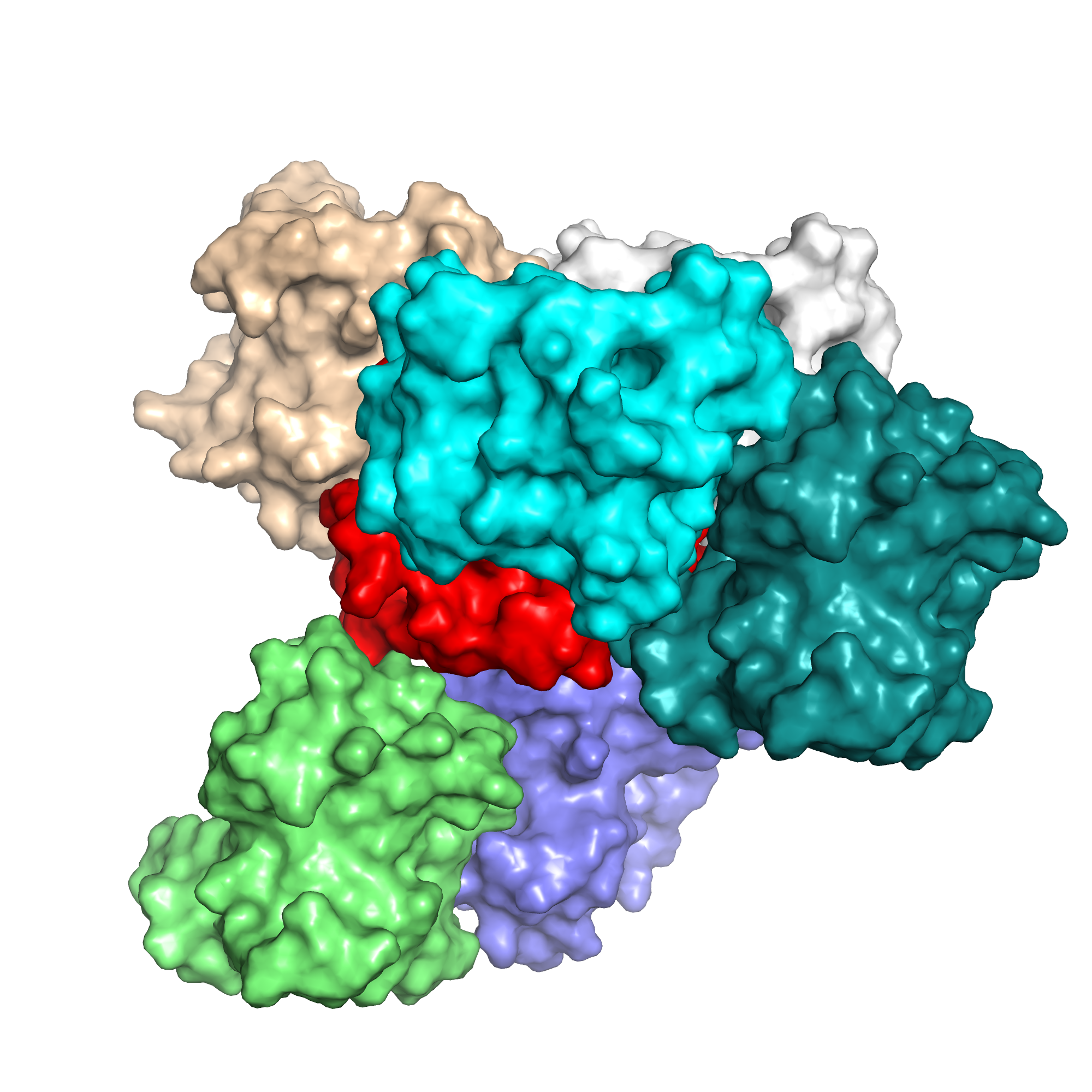
Задание 3. Кристалл
В данном задании мы изучали устройство кристалла структуры 7AOT. На Рис. 5 изображена структура кристалла при отсечке в 20 ангстрем.
На рисунке 6 изображены соседи по ячейке, с которыми белок непосредственно соприкасается. Таких соседей оказалось 6.