Исследование эффекта некоторых одиночных мутаций на структуру и функцию белка A0A3B4CPI2
Цель данного задания - предсказать эффект трех одиночных мутаций в белке с Uniprot ID A0A3B4CPI2. Это белок из Pygocentrus nattereri, обыкновенной пираньи, по гомологии аннотированный как субъединица 1 рецептора гамма-аминомасляной кислоты типа B (GABBR1). Интересующие нас мутации - это замены W468H, M502K и E540Q. В первую очередь, для выполнения данного задания нам нужно найти гомолог данного белка, для которого есть расшифрованная структура.
Наша субъединица - это компонент G-белок ассоциированного рецептора к гамма-аминомасляной кислоте (gamma-aminobutyric acid, GABA), представляющего собой гетеродимер. Именно исследуемая нами субъединица GABBR1 связывает GABA, в то время как GABBR2 отвечает за связывания с G-белком. GABA - это ингибиторный нейротрансмиттер, и рецепторы к ней располагаются на постсинаптических мембранах нейронов. Связывание GABA с данным рецептором как правило приводит за счет действия G-белков к открыванию K+-каналов, в результате чего клетка гиперполяризуется, то есть уменьшается вероятность ее возбуждения и возникновения потенциала действия. Кроме того, полученный данными рецепторами сигнал приводит к ингибированию аденилатциклазы, стимулированию фосфолипазы А2 и другим эффектам, характерным для метаботропных рецепторов.
Среди синтетических агонистов рецептора стоит упомянуть баклофен - препарат для лечения обратимой спастичности и последствий рассеянного склероза, а также гамма-оксимасляную кислоту (известную как оксибутират) - депрессант, по психоактивному действию схожий с алкоголем.
С помощью поиска по последовательности в PDB мы находим структуры аналогичного рецептора человека. Структуры с самой большой идентичностью по последовательности - 82% - кажутся не самыми подходящими для наших целей, потому как это CryoEM-структуры либо с довольно низким разрешением, либо без каких-либо лигандов, а нам для изучения эффекта мутаций точно они понадобятся. Лучше всего нам подойдет структура 4MS3 внеклеточного домена человеческого рецептора, полученная с помощью рентгенструктурного анализа и обладающая разрешением 2.5 Å и довольно хорошими метриками качества [1], фрагмент которой с 3 по 412 остатки на 81% совпадает с фрагментом белка A0A3B4CPI2 с 240 по 650 остатки (этот участок содержит все три интересующих нас остатка). Кроме того, для дополнительного подтверждения наших гипотез можно использовать структуру 7C7Q, представляющую собой весь рецептор целиком, исследованный с помощью криоЭМ с разрешением 3 Å [2], фрагмент которого с 22 по 864 остатки с идентичностью 76% выравнивается на остатки с 237 по 936 исследуемого нами белка. Лигандом структуры 7C7Q является упомянутый выше агонист баклофен, а структуры 4MS3 - собственно, GABA.
Таким образом, подходящие PDB-структуры с лигандом и с агонистом удалось найти, не прибегая к поиску с помощью PDBeFold. Тем не менее, структурный поиск по 4MS3 я все-таки запустил, но не нашел в выдаче структур, которые для меня были бы более удобными, чем 4MS3 или 7C7Q.
Открыв PDB-файлы, обнаруживаем, что файлы и 4MS3, и 7C7Q в строке DBREF цепи А содержат ссылку на Q9UBS5 - GABBR1 человека из Swiss-Prot. Построив выравнивание A0A3B4CPI2 и Q9UBS5, обнаруживаем, что остатку триптофана-468 соответствует в человеческом белке позиция 395, остатку метионина-502 - позиция 429, а остатку глутамата-540 - позиция 466. В КриоЭМ-структуре 7C7Q нумерация остатков такая и есть, а в структуре 4MS3 из-за обрезанной цепочки триптофан стоит на 278 позиции, метионин - на 312, а глутамат - на 349.
Замена W468H
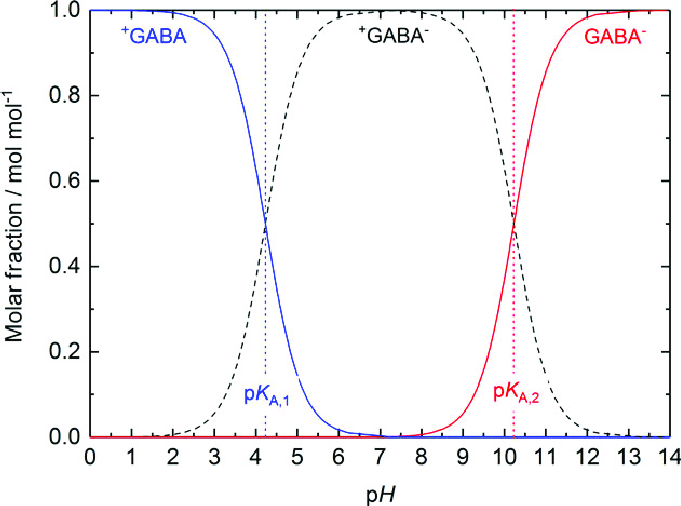
Триптофан-468 (он же 278 в РСА-структуре и 395 в криоЭМ-структуре) расположен прямо в сайте связывания и, по-видимому, между данным остатком и NH3-группой GABA может образовываться пи-катионный стекинг. О том, что аминогруппа GABA в физиологических условиях имеет положительный заряд, свидетельствует приведенный на рис. 2 график зависимости доли разных форм GABA от pH. Из литературы также известно, что между данным триптофаном и GABA существуют и Ван-дер-Ваальсовы взаимодействия [1].
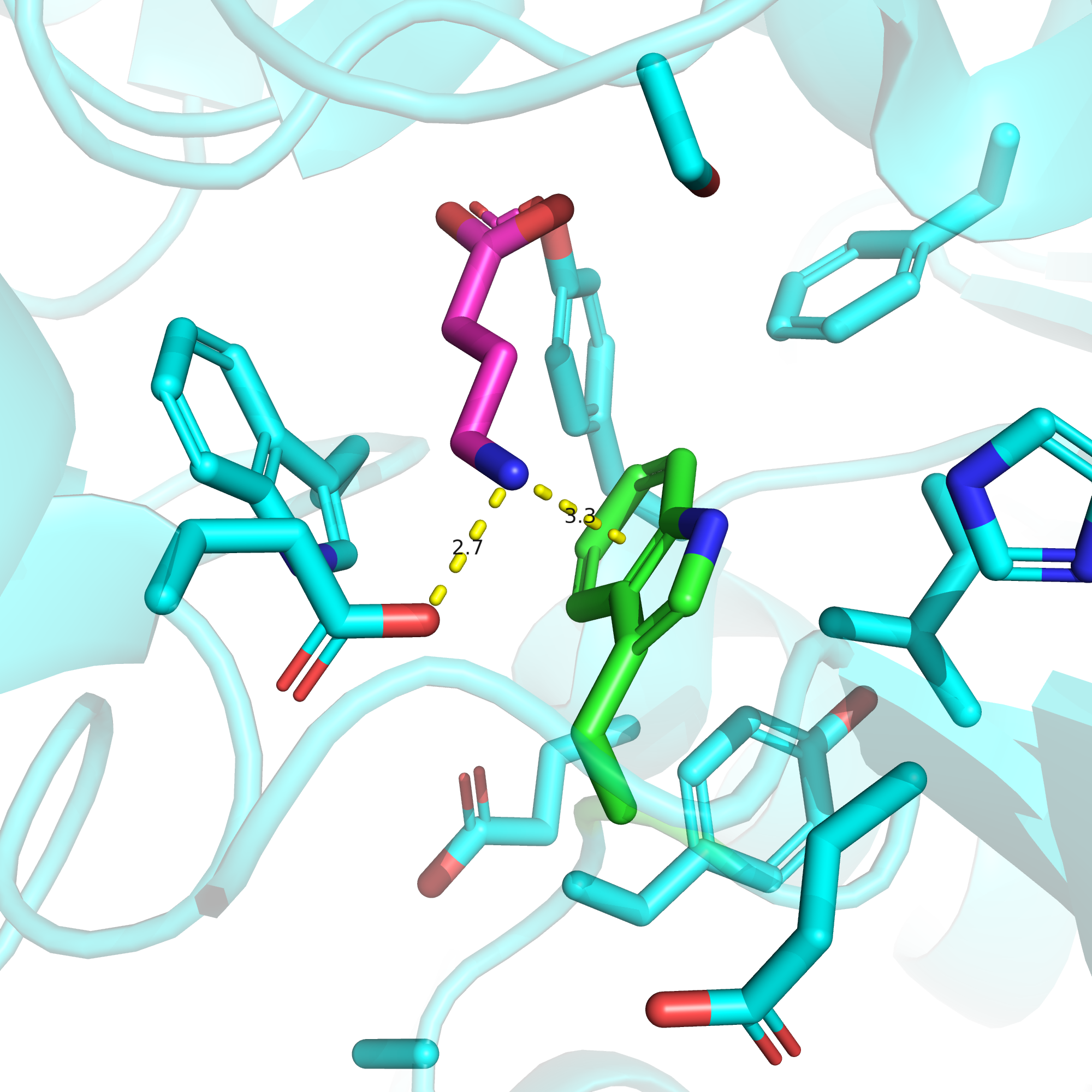
К чему же приведет замена данного триптофана на гистидин? Если гистидин не будет заряжен, он сможет образовывать пи-катионные взаимодействия с NH3-группой GABA так же, как это делает триптофан, а значит особо драматичной такая замена быть не должна. Однако если гистидин по каким-то причинам будет заряженным, он будет отталкиваться от NH3-группы и, напротив, взаимодействовать с показанным на рисунке 1 остатком глутаминовой кислоты (подробнее про этот остаток - см. ниже про третью мутацию). Это может сильно изменить конфигурацию сайта связывания и ухудшить аффинность.
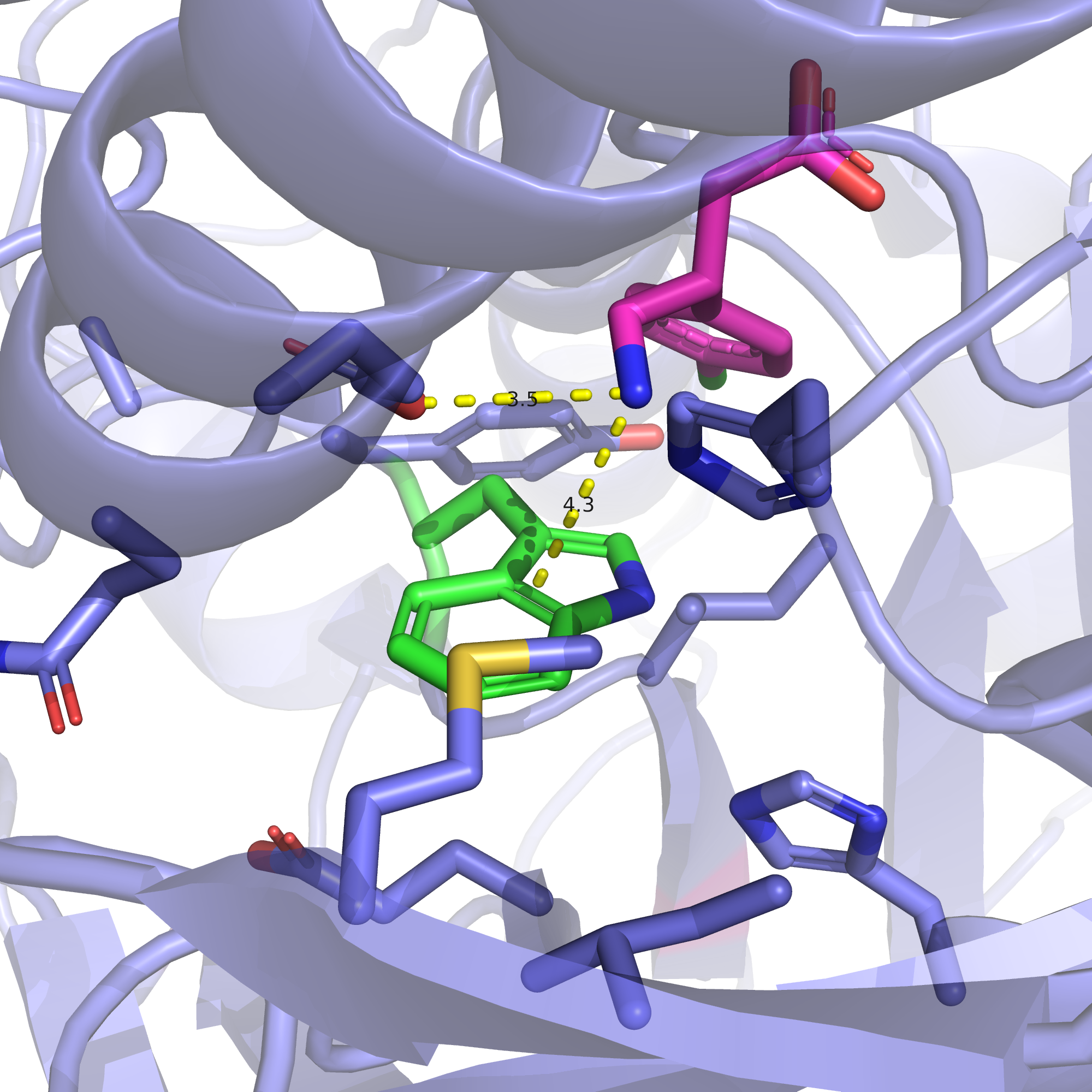
Давайте сперва обратимся к структуре 7C7Q, которую мы решили использовать для дополнительного подтверждения наших рассуждений. На рис. 3 изображен триптофан-395 данной структуры и его окружение. Видим, что тут конформация центра связывания немного иная (видимо, из-за связывания другого лиганда), и расстояние между NH3-группой агониста и пи-системой триптофана несколько больше, чем в 4MS3. Надо сказать, что в данном случае может происходить еще и стекинг триптофана с ароматическим кольцом баклофена (возможно, именно это немного смещает триптофан в сторону от NH3-группы).Тем не менее, несмотря на все эти различия, в целом ситуация выглядит аналогично: если гистидин в этой позиции не будет заряжен, серьезных изменений произойти не должно. Если же будет, то он потенциально сможет дестабилизировать карман связывания.
Попробуем заменить триптофан на гистидин в PyMOL, чтобы оценить, сможет ли вообще гистидин быть направлен своим кольцом так же, как триптофан, или же для него более благоприятной будет какая-либо иная конформация (например, приближающая его боковую цепь к глутамату, что плохо бы сказалось на функционировании рецептора). Обнаруживаем, что гистидин в данной позиции даже не сможет как-либо "вывернуться", поскольку показанный на рис. 4 ротамер - единственный, не создающий "клэшей". Применение sculpting подтверждает, что данное положение является оптимальным для гистидина.
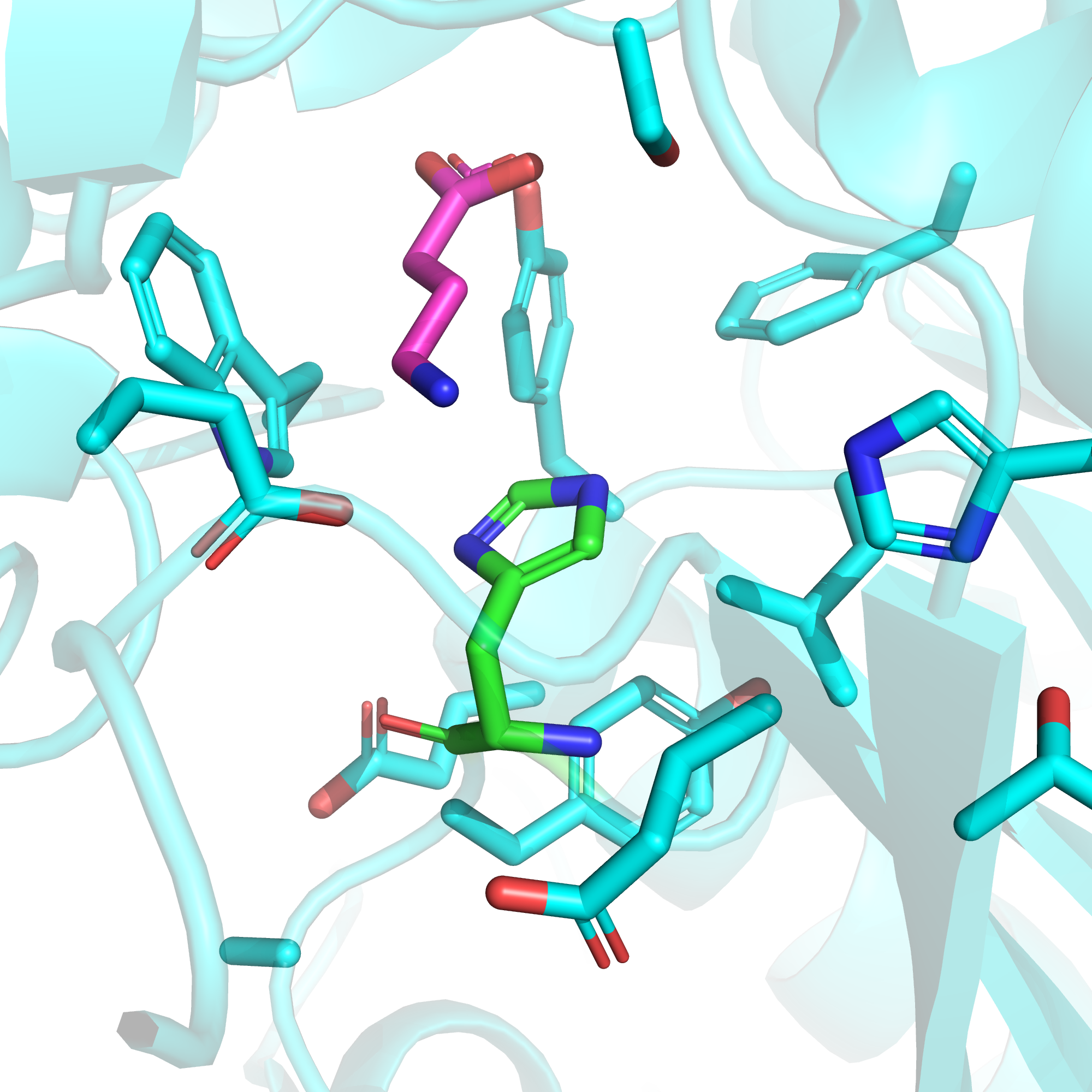
Чтобы предположить, будет ли гистидин заряженным в данной позиции, посмотрим на структуру 6WIV [3]. Это одна из упомянутых нами выше криоЭМ-структур с высокой идентичностью с нашей исходной последовательностью, которую мы отмели из-за отсутствия лигандов. Однако в данном случае нам интересно, какова конфигурация кармана связывания до прихода GABA.
На рис. 5 видим, что в отсутствие GABA триптофан "отвернут" от заряженных остатков и находится в гидрофобном окружении. При этом, как показали авторы структуры, рядом с данным остатком связывается ион Ca2+, являющийся, по-видимому, позитивным аллостерическим модулятором рецептора (показано, что ЭДТА, связывая кальций, снижает активность GABAB) [3]. И, по мнению авторов, роль кальция как раз заключается в опосредованном поддержании триптофана-278 в правильной конформации за счет стабилизации остатков неподалеку от него.
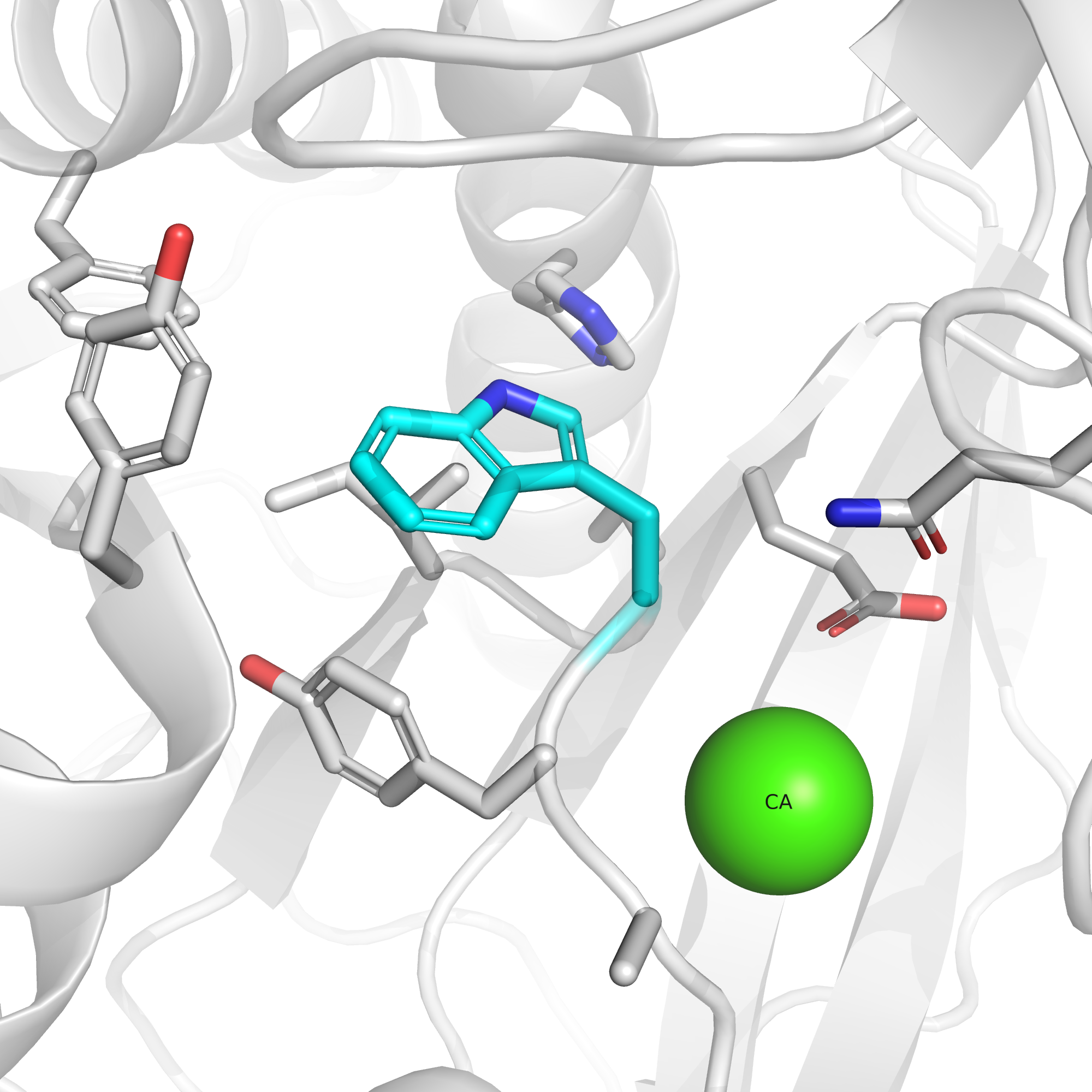
Что это означает для нас в контексте эффекта мутации? Можно предположить, что кальций, стабилизирующий положение триптофана, будет стабилизировать также и положение гистидина. Гистидин будет повернут к гидрофобным остаткам, а ион кальция будет взаимодействовать с отрицательно заряженными и не даст им сформировать солевой мостик с гистидином. Таким образом, мы можем надеяться, что гистидин в данной позиции не будет нести положительный заряд, а значит, как было сказано выше, не будет драматично снижать эффективность связывания GABA с исследуемым рецептором.
Замена M502K
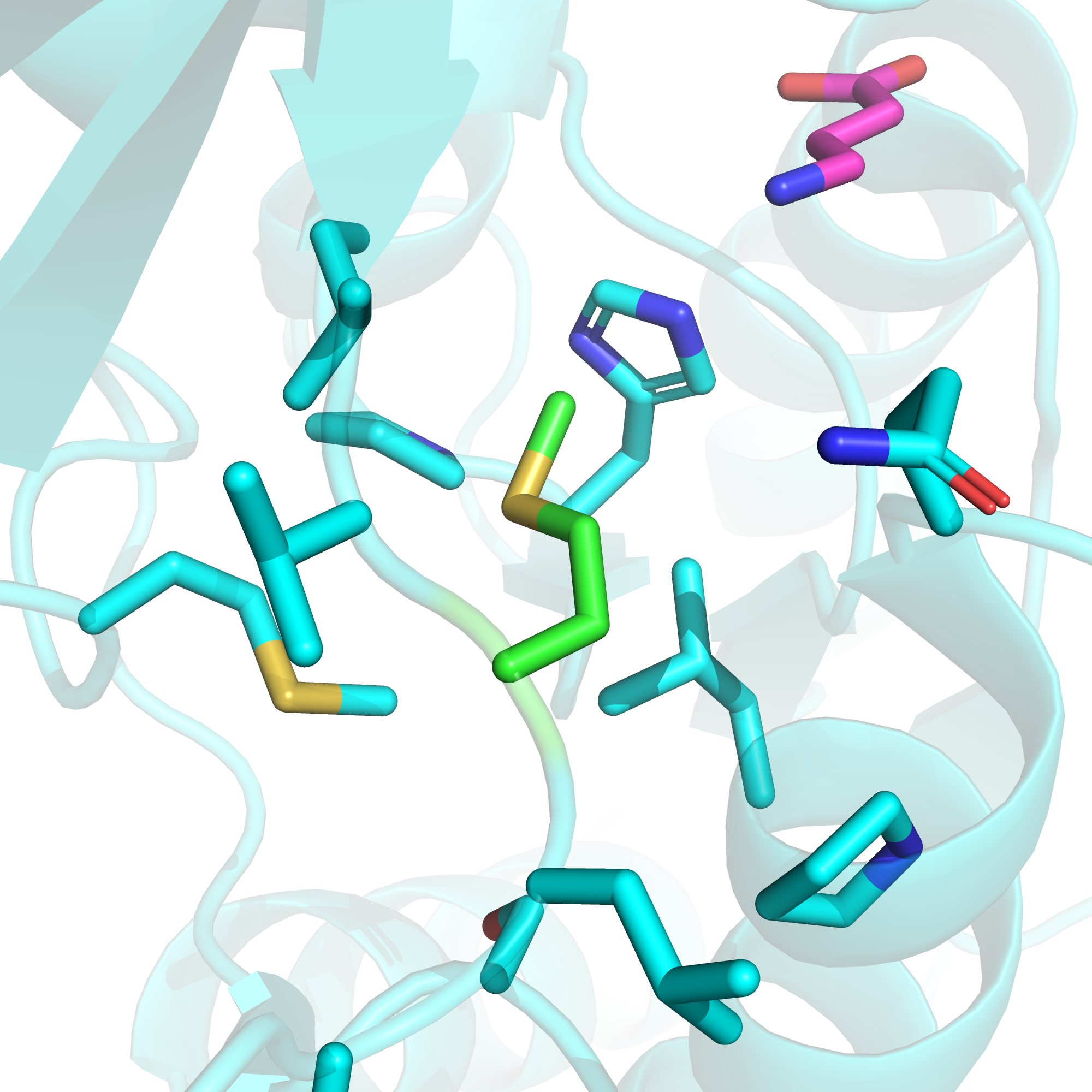
Метионин-502 в GABBR1 пираньи соответствует метионину-312 в структуре 4MS3. Окружение метионина-312 представлено на рис. 6. Как мы видим, данный остаток находится в гидрофобной области недалеко от сайта связывания нейротрансмиттера, а значит можно предположить, что замена его на лизин приведет к серьезным перестройкам в структуре.
Как мы видим из рис. 7, где показан лизин на месте метионина (ротамер с наименьшими клэшами), аминогруппа лизина еще и будет приближена к гистидину-170 (справа на рис. 5), и если тот будет заряжен положительно, их заряды будут друг от друга отталкиваться, что приведет к еще более серьезным перестройкам. Однако заряд гистидина в данной позиции - отдельный вопрос для изучения. Тем не менее, применение sculpting в PyMOL показывает, что никак вывернуться, чтобы избежать близости к гистидину и другим остаткам, лизин на этом месте не сможет, а значит структурные изменения неизбежны.
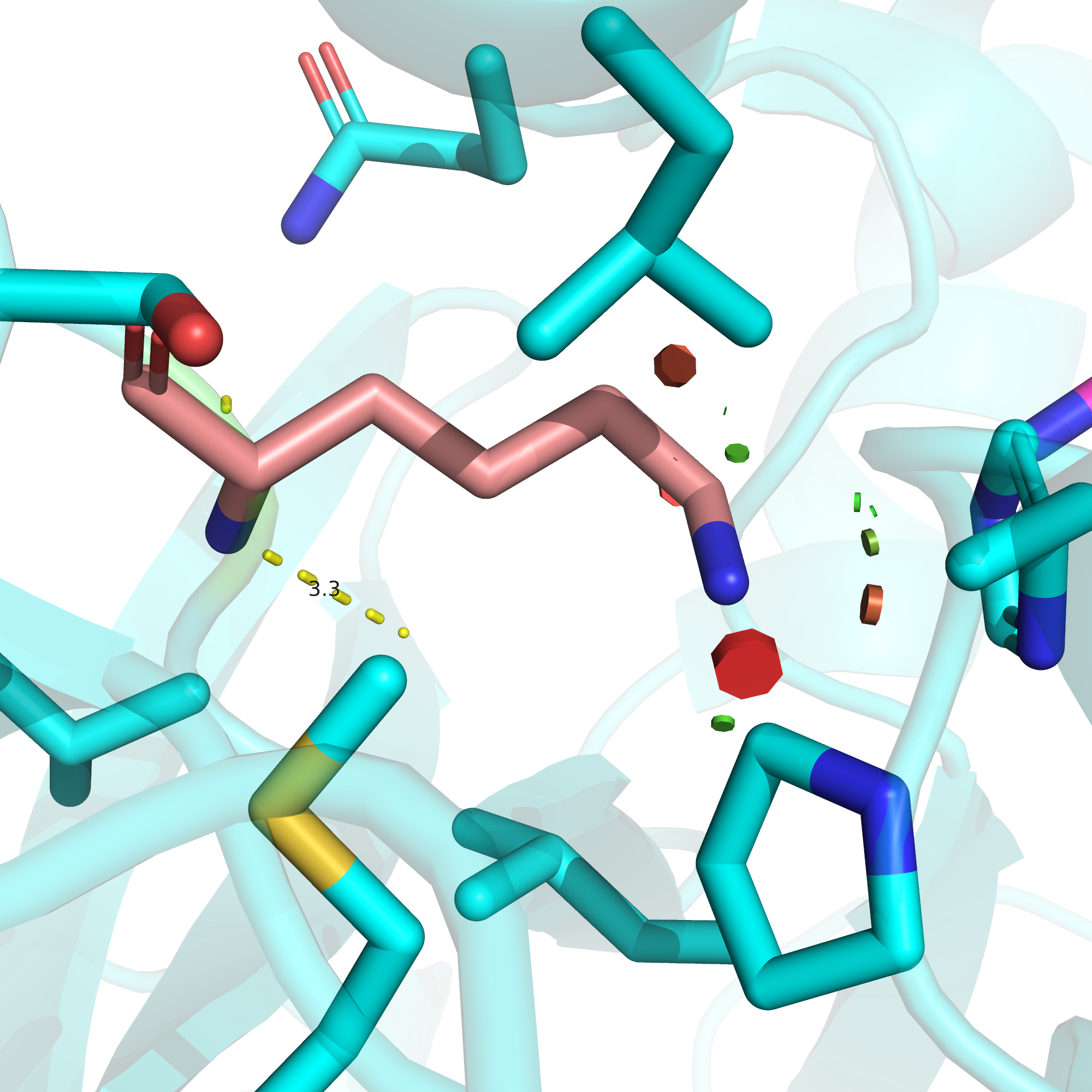
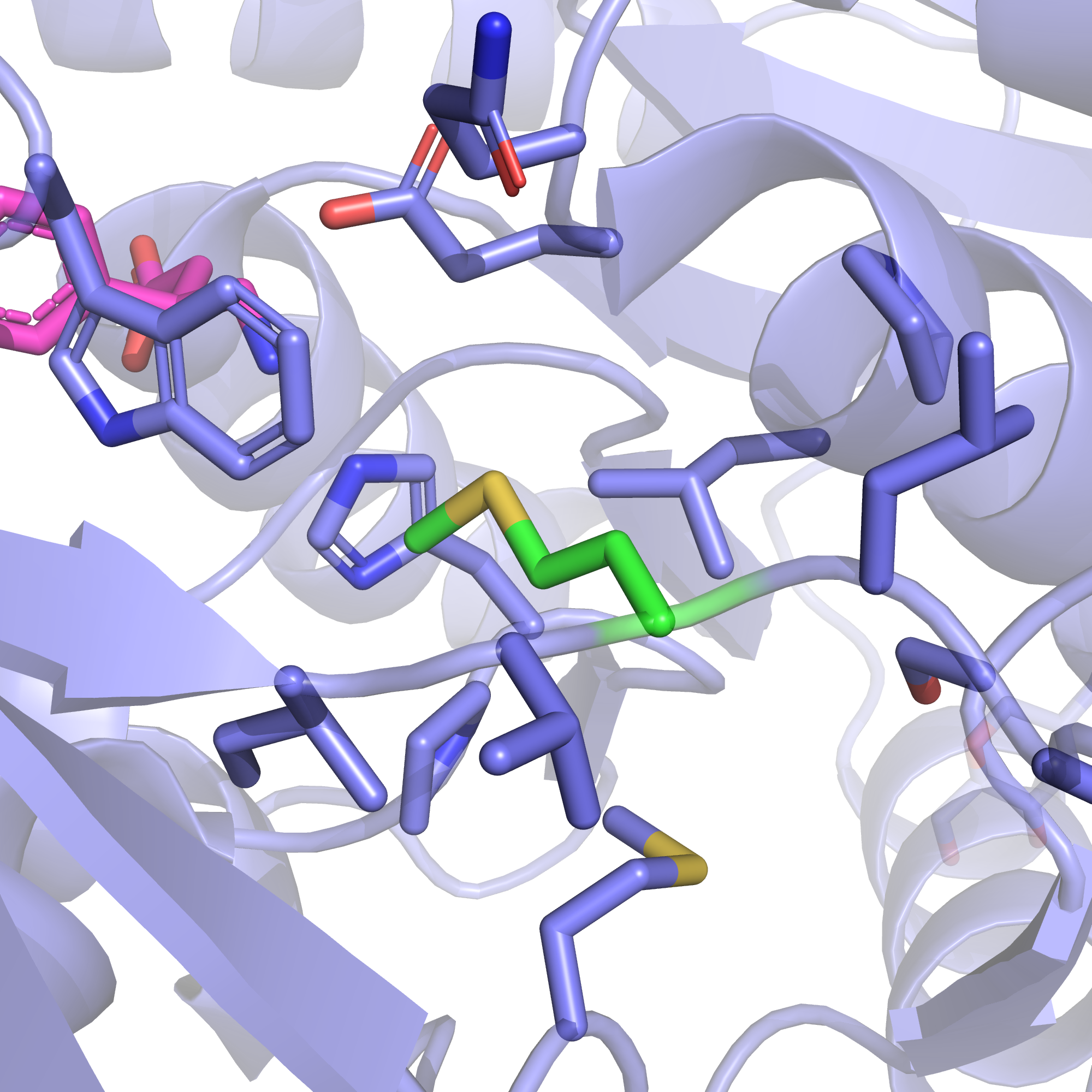
Взглянув на соответствующий метионин в криоЭМ-структуре, убедимся в сделанных нами предположениях, т.к. и в этой структуре метионин явно находится в гидрофобной области. Из рис. 8 может показаться, что расположенные сверху глутамин и глутамат могут стабилизировать положительный заряд лизина, однако на самом деле они находятся довольно далеко, и ни один из ротамеров лизина, если поставить его в точности на место метионина, не сможет развернуться в их сторону, не конфликтуя с расположенным на рисунке слева сверху триптофаном.
Все это позволяет нам заключить, что замена метионина на лизин в данной позиции приведет к изменениям в структуре рецептора, причем эти изменения произойдут недалеко от сайта связывания GABA. Хотя и есть вероятность, что белок сможет каким-то образом скомпенсировать эту реорганизацию и сохранить сайт в не слишком изменененном состоянии, данная мутация, в любом случае, вряд ли будет совсем уж нейтральной или, тем более, благоприятной.
Замена E540Q
Остатку 540 данной нам последовательности соответствует остаток глутамата-349 в структуре 4MS3, который хорошо виден на рис. 1, дублирую этот рисунок ниже. Этот остаток, как мы уже сказали при обсуждении первой мутации, образует солевой мостик с аминогруппой GABA.

Что же произойдет, если на месте глутамата будет стоять глутамин? Чтобы ответить на этот вопрос, внесем данную мутацию в PyMOL. Подавляющее большинство ротамеров глутамина создают в этой позиции очень серьезные клэши. Если же клэшей удается избежать, то, как видно на рис. 9, к аминогруппе GABA оказывается обращена даже не карбонильная, а аминогруппа глутамина. В такой конфигурации единственное возможное взаимодействие с GABA этого ключевого для функционирования рецептора остатка - это водородная связь, в которой аминогруппа лиганда должна выступать акцептором, а значит быть NH2-, а не NH3-группой. Это минорное состояние при нормальной кислотности среды для этого лиганда, а значит мы будем наблюдать очень низкую функциональность.
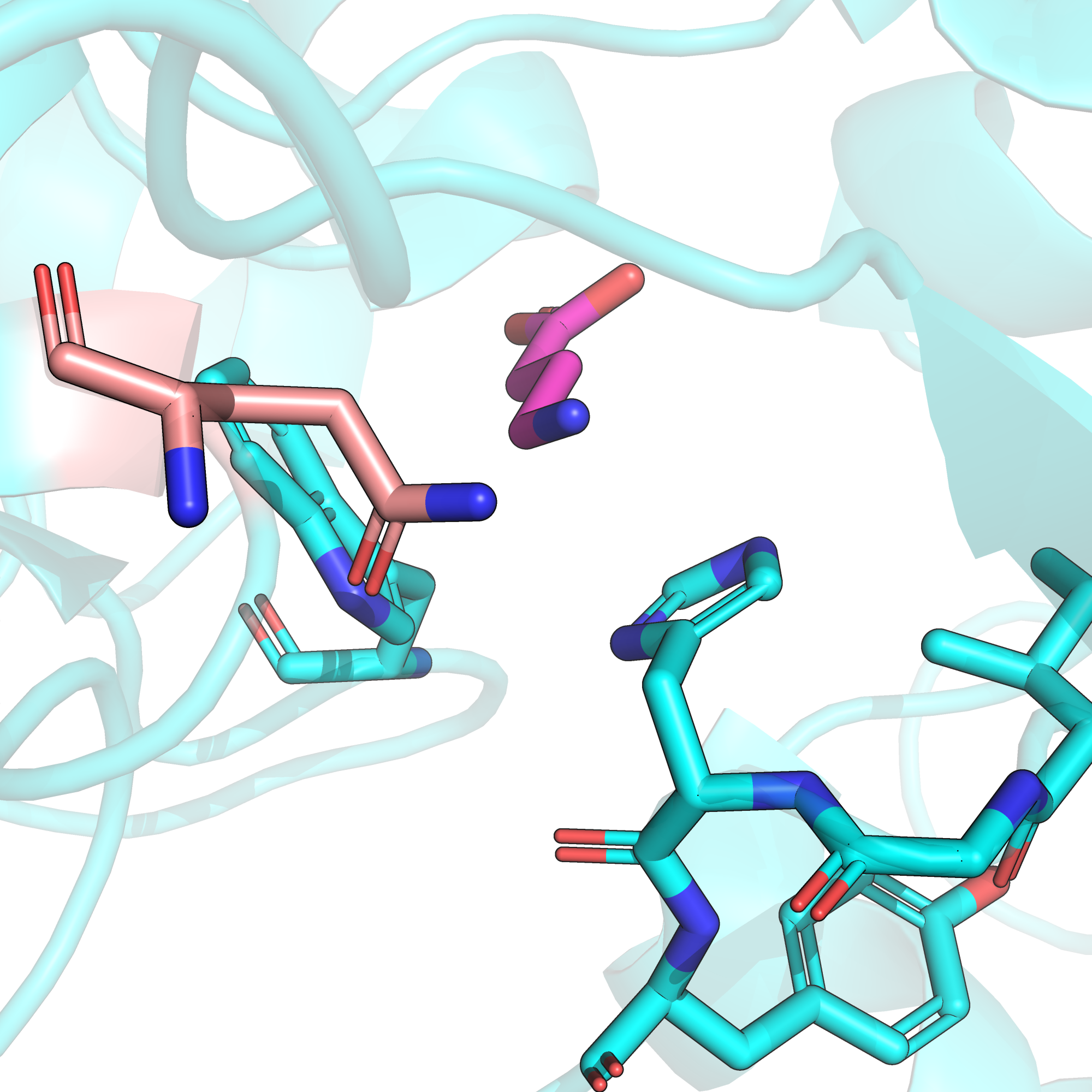
По-видимому, из трех рассмотренных нами мутаций данная замена является наименее благоприятной, поскольку она задействует непосредственно сайт связывания и полностью убирает возможность образования солевого мостика, важного для связывания GABA со своим рецептором.
Список литературы
1. Geng, Y., Bush, M., Mosyak, L. et al. Structural mechanism of ligand activation in human GABAB receptor. Nature 504, 254–259 (2013). https://doi.org/10.1038/nature12725
2. Mao, C., Shen, C., Li, C. et al. Cryo-EM structures of inactive and active GABAB receptor. Cell Res 30, 564–573 (2020). https://doi.org/10.1038/s41422-020-0350-5
3. Park, J., Fu, Z., Frangaj, A. et al. Structure of human GABAB receptor in an inactive state. Nature 584, 304–309 (2020). https://doi.org/10.1038/s41586-020-2452-0