| Учебный сайт Саши Погорельской |

|
|
||||||
| Главная | Семестры | Скрипты | Обо мне | Ссылки | ||
|
|
Триптофан-синтаза, поиск аналогов Исходным белков для поиска является триптофан-синтаза, идентификатор в базе данных PDB - 1TJP. Это белок из бактерии Salmonella typhimurium (штамм LT2 / SGSC1412 / ATCC 700720). Этот белок, катализирующий реакцию синтеза триптофана из компонентов, изображенных на рисунках 1-2. В UniProt есть 2 записи, соответствующие этому белку, для α-цепи и для β-цепи.
Работа производилась с помощью сервера PDBeFold. Условиями поиска были стоявшие по умолчанию. Просмотрена 96131 запись PDB (248204 цепочек), из них найдено 1563 аналогов (включая исходную). Я искала сходные с цепью α. Будем рассматривать белок STRUCTURAL BASIS OF MUTUAL ACTIVATION OF THE TRYPTOPHAN SYNTHASE A2B2 COMPLEX FROM A HYPERTHERMOPHILE, PYROCOCCUS FURIOSUS - 81 находка. Организм, которому принадлежит этот белок относится к археям. То, что сходная последовательность встречается в бактериях и археях говорит о значимости этого белка. Код PDB 1wdw (цепочка G - одна из 12, входящих в состав этого белка), сопоставлено 231 α-атомов (из 267). Мера сходства структур составляет 1.43 ангстрем, совпадает 32% аминокислотных остатков. Есть 9 гэпов - участков расхождения полипептидных цепей (концевые расхождения не учитываются). 90% вторичных структур (α-спиралей и β-листов) исходной последовательности и 100% вторичных структур находки было сопоставлено. Для проверки данных о находке я рассмотрела пространственное совмещение белков. Критерием совпадения Сα-атомов было расстояние 1,5 ангстрем. Я определила множества (команда define в Jmol) Сα-атомов, расположенных на этом расстоянии на обеих цепочках. Результат представлен на рисунке 3. Совпавшие атомы показаны в толстой проволочной модели (остов), а вторичные вторичные структуры в модели cartoons с прозрачностью 80%. На расстоянии не более 1,5 ангстрем находятся 177 атомов, что существенно меньше указанного при поиске. Также на рисунке 3 видно, что при таком условии совмещено меньше 90% вторичных структур. 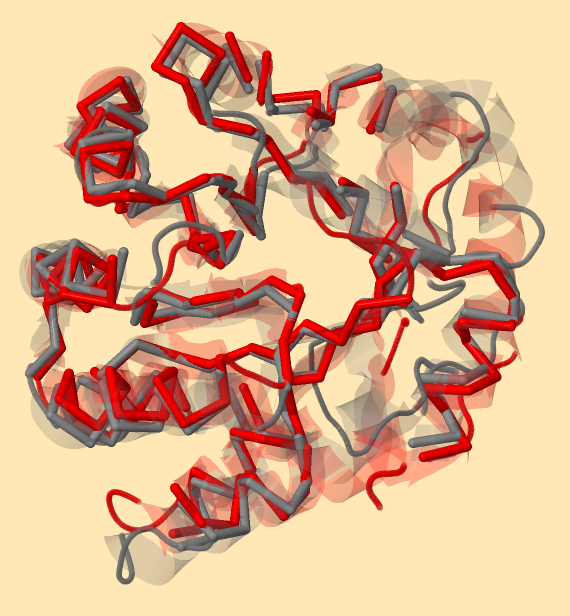
Рисунок 3. Совмещение структур белков в модели cartoons. Серым цветом покрашен исходный белок, красным - найденный Для получения рисунка 3 с точностью до поворота я использовала следующий скрипт:
На рисунках 4 и 5 изображен участок цепей с одним из расхождений. На исходной последовательности это участок от 32 до 52 аминокислоты, на находке - от 20 до 39. Видно, что в месте расхождения исходная цепь (показана серым цветом) имеет другой изгиб, содержащий два аминокислотных остатка, в то время как в находке (показана красным цветом) один остаток. При этом вторичная структура практически не отличается: α-спираль исходной последовательности немного длиннее.
|
|||||||||||||||||||||||||||||||||||||||
| © Pogorelskaya Sasha | Last modification date: 19.02.15 | ||||||||||||||||||||||||||||||||||||||||