Определение вторичной структуры
Для работы был выбран белок из структуры 4GUW, подходящий под условия задания (наличие хотя бы одной альфа-спирали и бета-листа).
Далее структура была подана на вход программе для предсказания вторичной структуры DSSP. Результат работы программы можно скачать
этой ссылке.
Необходимо было затем сравнить выдачу программы с реальным расположением вторичных структур в белке. Таблицу с полным сравнением
предсказания программы и реальности можно скачать по этой ссылке.
Сравнение предсказания двух альфа-спиралей и двух бета-листов - таблица 1.
Можно заметить, что программа предксазывает бета-листы точнее альфа-спиралей, хотя в данном случае возможно немного различающееся
определение начала альфа-спирали авторами программы и PDB.
Таблица. 1. Сравнение предсказания вторичной структуры программой DSSP и данными PDB.
| Тип вторичной структуры | Границы в реальности | Границы, предсказанные DSSP |
|---|---|---|
| Тяж | Y47-F53 | Y47-F53 |
| Тяж | T59-D65 | T59-D65 |
| α-спираль | E85-S92 | P86-A91 |
| α-спираль | N110-G119 | Y111-A118 |
Следуюшим заданием был поиск редких элементов вторичной структуры - β-мостов,
перекрученных спиралей (3-10) и недокрученных спиралей (5-17 или π-спирали). Программа DSSP своей выдаче предксазывает
подобные структуры.
К сожалению, в моей структуре π-спиралей она найти не смогла (это не говорит о том, что там их нет,
хотя они действительно редки в природе). Потому была выбрана структура-рекордсмен по количеству π-спиралей (2A65). К сожалению,
в ней DSSP также найти их не смогла. При обращении к статье
(Evolutionary origin of a secondary structure: π-helices as
cryptic but widespread insertional variations of α-helices enhancing protein functionality),
где искали структуры с π-спиралями (по предположению авторов,
они играют важную роль в процессе эволюции) была взята таблица,
предлагаемая авторами с отмеченными участками, имеющими
недокрученные спирали.
В этой статье также замечалось, что DSSP ищет 5-17 спирали не очень успешно. Как пример приводилось как раз ненахождение им
ни одной π-спирали в структуре-рекордсмене по их количеству. Предполагается, что это связано с малыми размерами таких
спиралей в аминокислотных остатках и тем, что они чаще всего по бокам фланкированы альфа-спиралями.
Часть из найденные структур приведены в таблице 2, включая π-спираль из 2А65.
Сессию Pymol для редких вторичных структур из 4guw можно скачать
по этой ссылке.
Для π-спирали из 2A65 - по этой ссылке.
Таблица. 2. Примеры редких элементов в структурах
| Название элемента | Границы | Изображение |
|---|---|---|
| β-поворот | L6-A9 | 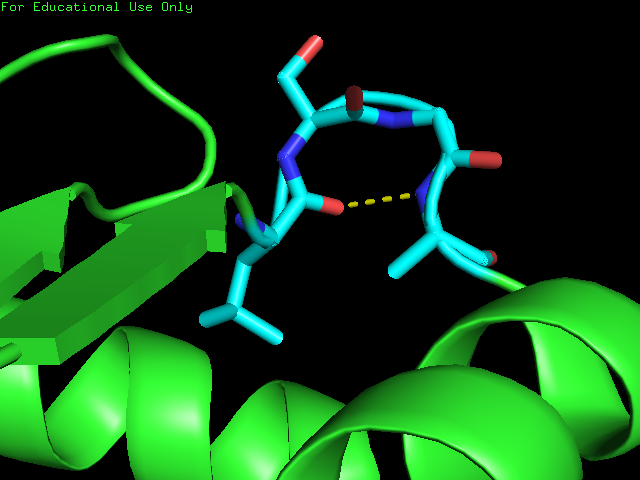 |
| 3-10 спираль | K120-I125 | 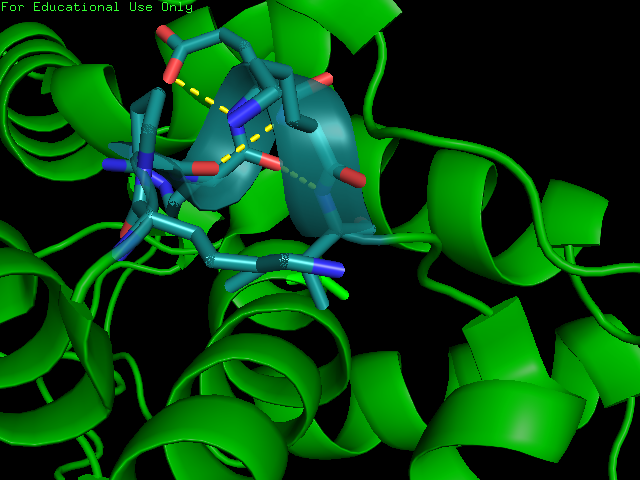 |
| β-мост | E179 и I127 | 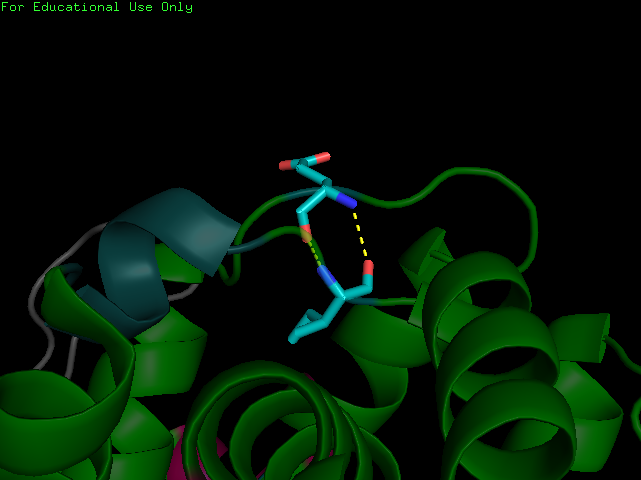 |
| π-спираль | структура 2a65 N321-L327 | 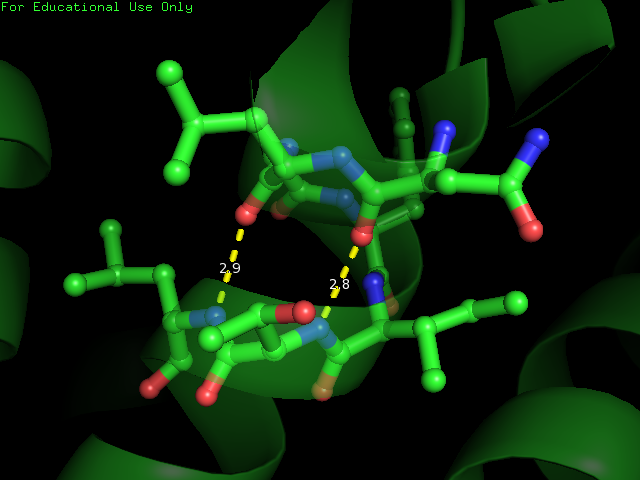 |
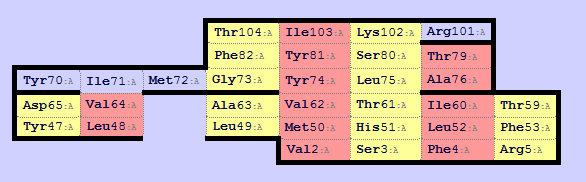
В следующем задании при помощи сервиса SheeP необходимо построить карту одного из бета-листов в структуре. Увидеть изображение, полученное SheeP можно на рис.1. Соответствующую ему визуализацию в Jmol можно увидеть на рис.2. Видно, что красным выделены остатки, направленные в гидрофобную область.
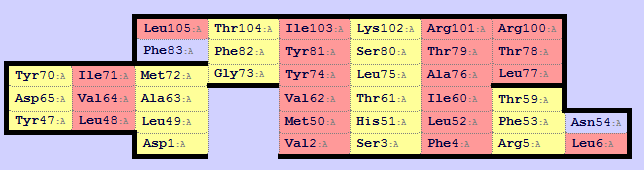
Рисунок. 1. Карта ?-листа, полученная Sheep
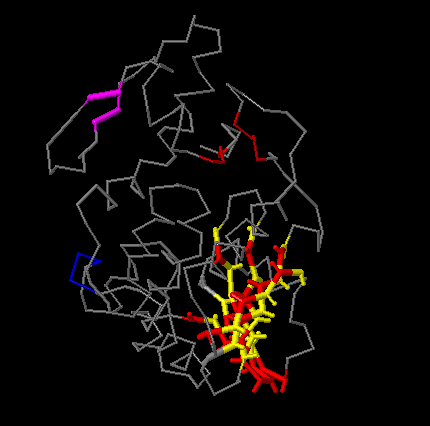
Рисунок. 2. Визуализация в Jmol. Искомый лист покрашен в желто-красный.
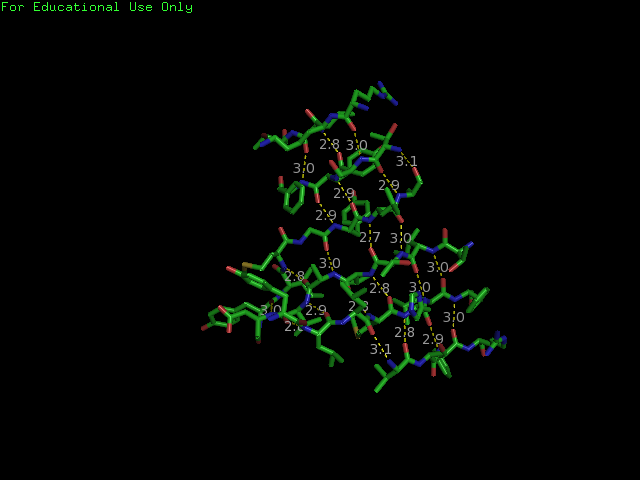
Далее с помощью этого же сервиса с использованием опции beta-sheets detector - Original STRIDE
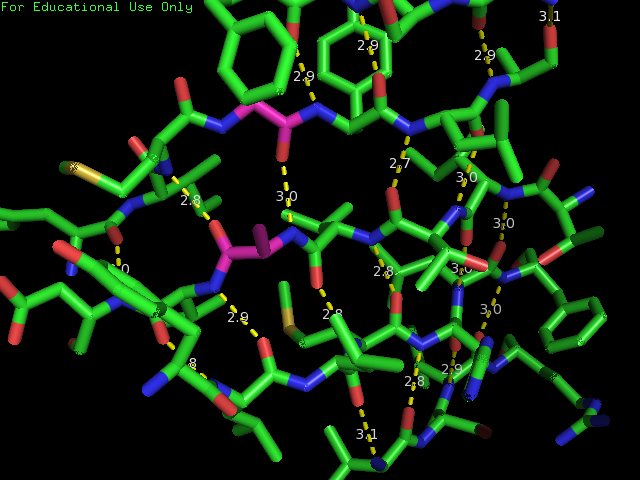
было опять получено изображение бета-листа (рис. 3.). С помощью консольной версии программы STRIDE был получен список водородных
связей(скачать можно по этой ссылке) и это было
визуализировано в Pymol (рис. 4.). Видно, что в данном листе есть нерегулярность ((buldge) -
она показано на рис. 5.
Рисунок. 3. Карта β-листа, полученная Sheep с использовнием Original Stride в качестве
детектора β-листов. Рисунок. 4. Визуализация водородных связей в листе в Pymol Рисунок. 5. Визуализация водородных связей в листе в Pymol. Нерегулярность выделена бордовым цветом.