| Учебный сайт Саши Погорельской |

|
|
||||||
| Главная | Семестры | Скрипты | Обо мне | Ссылки | ||
|
|
Сравнение структур, полученных с помощью РСА и ЯМР Для выполнения этого практикума я выбрала белок IIAglc бактерии Bacillus subtilis. В 1992 году была решена его структура методом рентгено-структурного анализа с разрешением 1.9 ангстрем (идентификатор в базе данных PDB: 1GPR), а в 1998 - методом ядерно-магнитного резонанса (идентификатор 1AX3). Структуры визуально сильно похожи по расположению элементов вторичной структуры, наблюдаются значительные расхождения в области свободных белковых цепей для многих из 16 предсказанных методом ЯМР структур. Для сравнения двух моделей я выбрала 3 прдеполагаемые водородные связи в струкуктуре, полученной методом РСА (рисунок 1). Эти связи относятся к разным структурным частям белка: между остовными атомами бэта-тяжей (Ile80 и Leu72, расстояние 2.8 ангстем), между боковыми группами на поверхности белковой глобулы (Arg57 и Glu107, расстояние 3.4 ангстрем) и в ядре белка (расстояние 3.0 ангстрем, боковая цепь His83 и атом кислорода Gly85, принадлежащий пептидной связи). 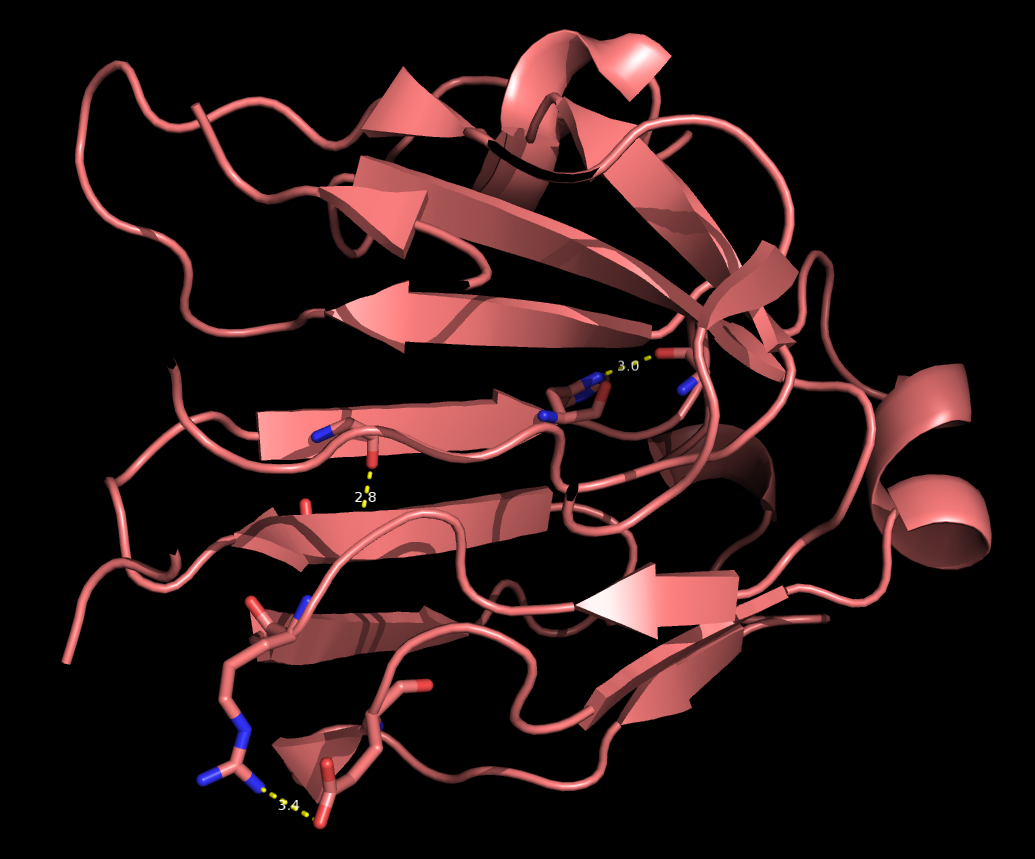 Рисунок 1. Пример предполагаемых водородных связей, предсказанных методом РСА (идентификатор 1GPR). Изображение получено с помощью Pymol Критерием наличия водородной связи было расстояние между атомами меньше 3.5 ангстрем. Таблица расстояний для соотвествующих атомов 16 ЯМР моделей можно посмотреть здесь. Водородная связь между тяжами бэта-листа присутсвует во всех моделях, расстояния между атомами всегда 2.8 - 2.9 ангстрем. Это ожидаемое наблюдение, водородные связи, удерживающие вторичную структуру должны быть наиболее устойчивыми. Другой предсказуемый результат - подвижность боковых цепей, располагающихся в петлях белка на поверхности глобулы. Для выбранной мной пары Arg57 и Glu107 во всех моделях атомы располагаются далеко друг от друга (медиана - 8.05 ангстрем). Эта связь не стабилизирована окружающей ее жесткой структурой, и поэтому такие боковые группы могут занимать более вариабельное положение. Промежуточный результат получился при анализе взаимодействия в ядре белка между боковой группой гистидина и атомом кислорода пептидной связи глицина. 7 моделей ЯМР (из 16) включают эти атомы на расстоянии, большем чем 3.5 ангстрем (медиана 5.45 ангстрем). |
||||||||||||||||
| © Pogorelskaya Sasha | Last modification date: 6.12.16 | |||||||||||||||||