| Учебный сайт Саши Погорельской |

|
|
||||||
| Главная | Семестры | Скрипты | Обо мне | Ссылки | ||
|
|
Внутримолекулярные взаимодействия боковой цепи белка-регулятора транскрипции Syntrophus aciditrophicus SB Одним из внутримолекулярных взаимодействий являются водородные связи. Об образовании этих связей подробнее написано во вкладке "Вторичные структуры". Благодаря этим связям, 2 цепи белка-регулятора транскрипции держатся вместе. На рисунках 1-2 кажется, что атом азота, входящий в состав радикала аргинина, образует 3 связи с атомами кислорода. На самом деле, эти связи образованы атомом водорода, соединенным с азотом, однако водород не прописывается в pdb-файлах. С двумя атомами кислорода, принадлежащими основной цепи валина и изолейцина, образуются водородные связи. Длины этих связей равны 2,765 и 3,199 ангстрем соответственно. Связь с боковым атомом кислорода аспартата имеет длину 3,166 ангстрем, но эта связь является солевым мостиком (подробнее ниже).
Солевые мостики довольно распространены в белках. Основой их образования также являются водородные связи, но они дополнительно укреплены электростатическим притяжением. Поэтому их длина меньше водородных, а энергия больше. 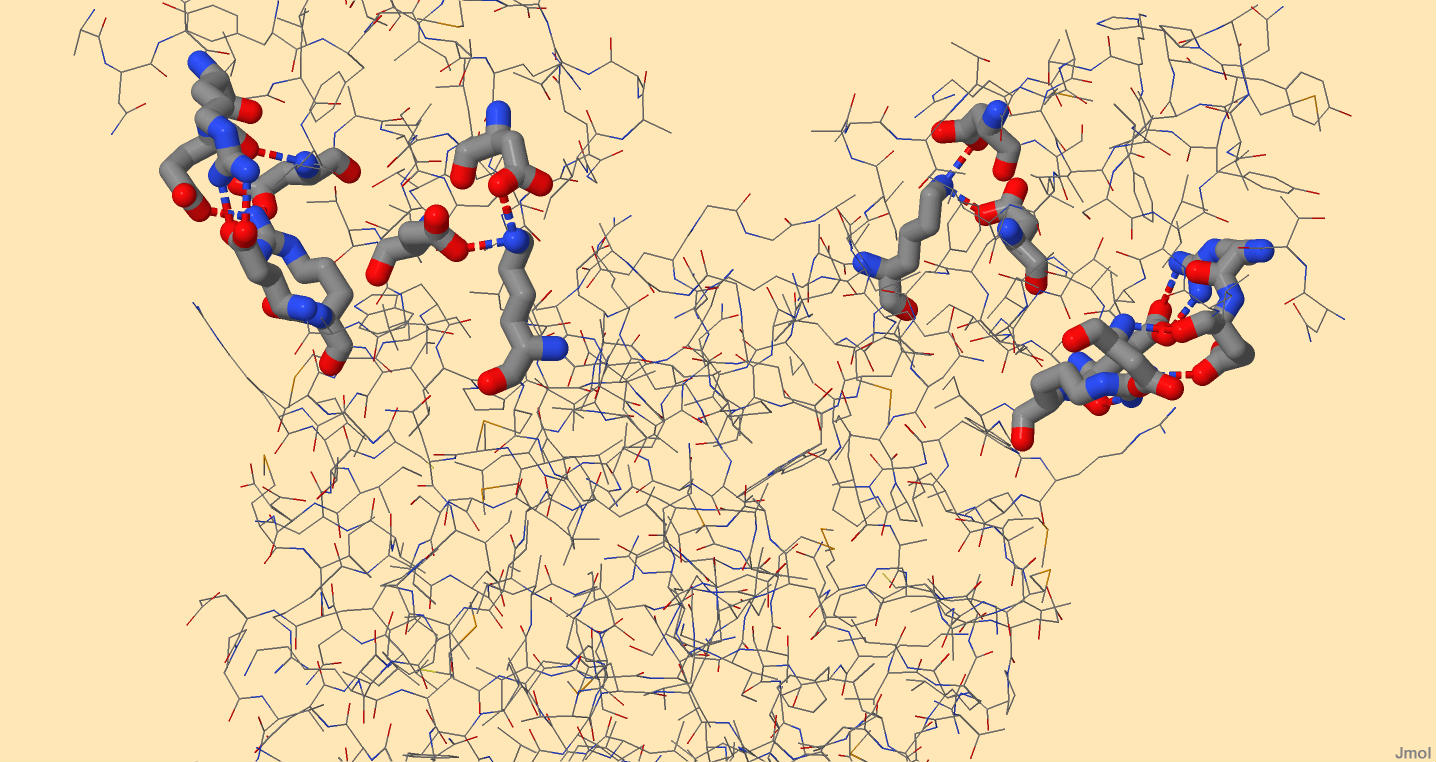
Рисунок 3. Солевые мостики белка-регулятора транскрипции
Еще одно распространенное внутримолекулярное взаимодействие - взаимодействие двух остатков цистеина. Их боковой радикал содержит группу -SH, две такие группы при определенных условиях способны реагировать, образуя дисульфидный мостик. В белке-регуляторе транскрипции есть 4 остатка цистеина, расположенные в разных частях молекулы, поэтому они не могут образовывать дисульфидные мостики - рисунок 6. 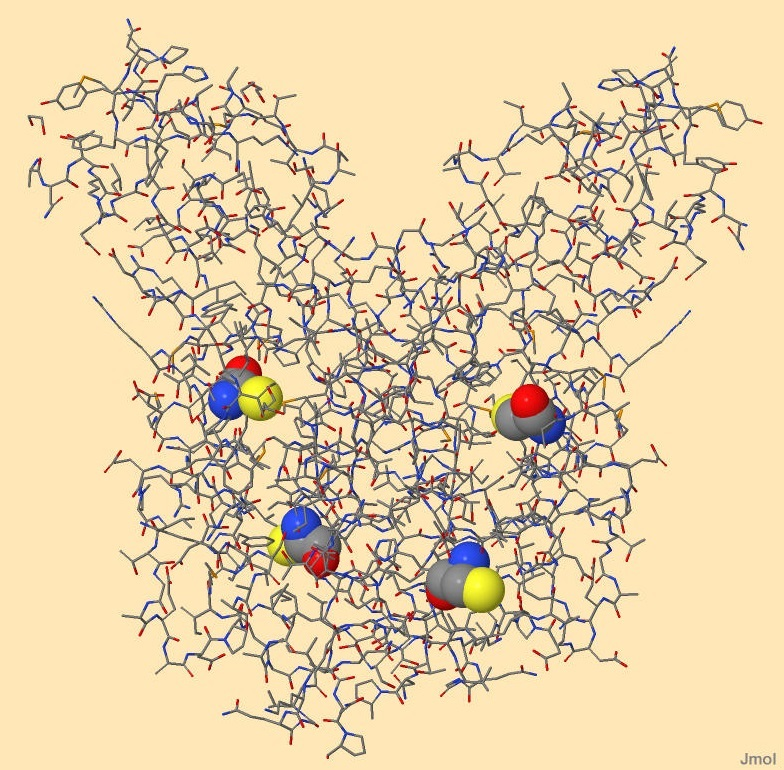
Рисунок 6. Остатки цистеина в белке-регуляторе транскрипции. Не образуют дисульфидных мостиков В полипептиде, рассмотренном для примера во вкладке "Вторичные структуры", образуется один дисульфидный мостик, изображенный на рисунках 7-8. Длина этой связи 1,997 ангстрем, а образуемый двугранный угол равен -32°. 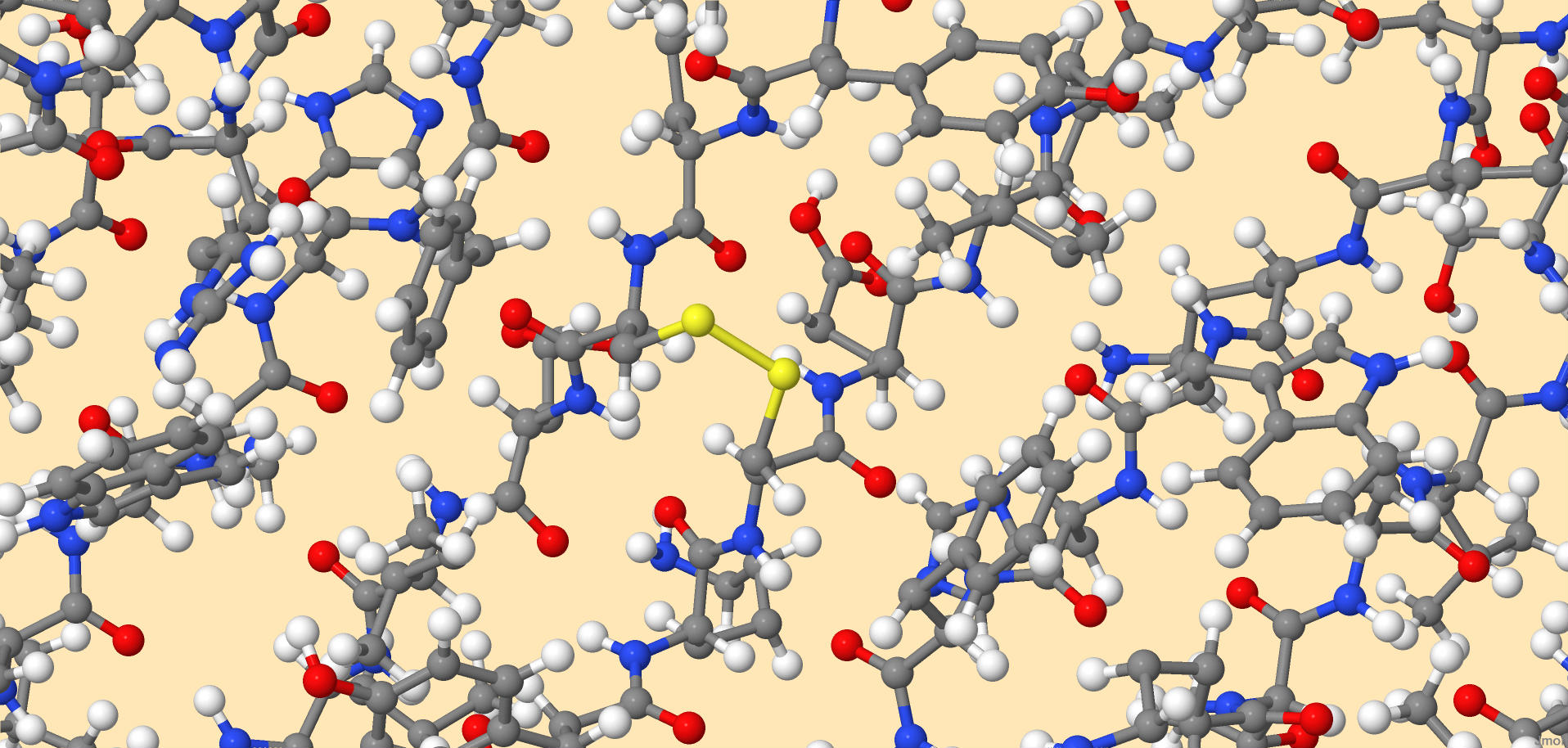
Рисунок 7. Дисульфидный мостик в молекуле восьмицепочеченого β-листа (идентификатор 1JY4). Образован 2 остатками цистеина 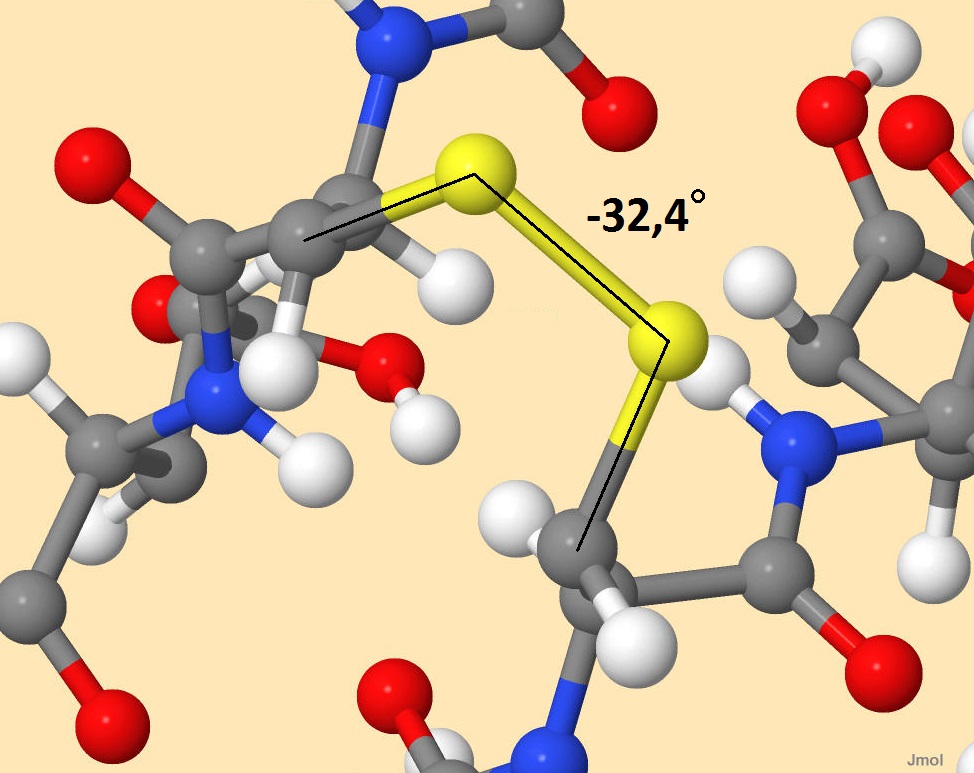
Рисунок 8. Дисульфидный мостик в молекуле восьмицепочеченого β-листа (идентификатор 1JY4). Двугранный угол равен -32,4° |
|||||||||||||||||||||||||||
| © Pogorelskaya Sasha | Last modification date: 19.02.15 | ||||||||||||||||||||||||||||