| Учебный сайт Саши Погорельской |

|
|
||||||
| Главная | Семестры | Скрипты | Обо мне | Ссылки | ||
|
|
Элементы вторичной структуры и остовные водородные связи белка-регулятора транскрипции Syntrophus aciditrophicus SB Вторичную структуру имеет любой белок. Она полностью определяется первичной (то есть аминокислотной последовательностью) и образуется за счет многочисленных водородных связей. Как отмечено в предыдущем разделе, отличия во вторичных структурах при совпадении последовательностей, скорее всего, связаны с ошибками при получении pdb-файла. Конкретнее это рассмотрено ниже. Существуют 2 различных типа укладки цепи аминокислот - α-спираль и β-складчатый лист. В белке-регуляторе транскрипции встречаются только α-спирали. Радикалы при этом направлены от пептидного остова в стороны. На рисунке 1 показана одна пара α-спиралей (на А и В цепях). Эти α-спирали начинаются с 9 аминокислотного остатка - Аспарагина, а заканчиваются 26 - Глицином. За α-спиралью следует резкий поворот остова в молекуле, поэтому именно глицин (обладающий самым маленьким радикалом) располагается в этом месте. 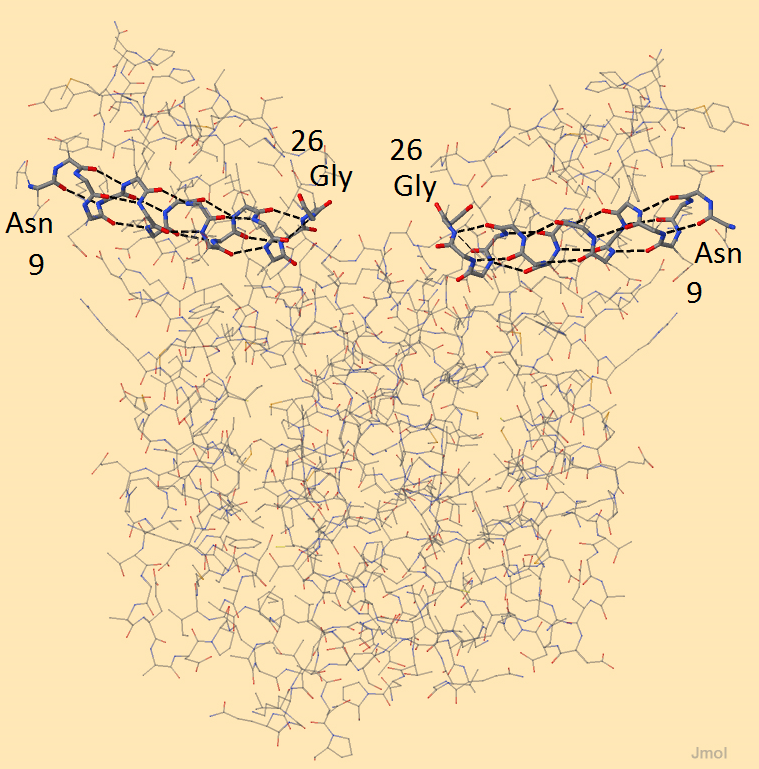
Рисунок 1. Пара α-спиралей белка-регулятора транскрипции По рисунку 1 можно посчитать количество аминокислотных остатков на виток спирали - между 3 и 4 (точное значение - 3,6). Это правозакрученная α-спираль, именно такая наиболее распространена в природе. Водородные связи, поддерживающие эту структуру, образуют атомы главной цепи - кислород и водород, связанный с азотом, каждый аминокислотный остаток образует 2 водородные связи. Атом кислорода, входящий в аминокислотный остаток под номером х, образует водородную связь с атомом водорода (х+4) остатка. Если на одном атоме возникает повышенная электронная плотность (частично отрицательный заряд), а на соседнем - недостаток (частично положительный заряд), то по донорно-акцепторному механизму образуется слабая связь. Разряжение плотности на водороде усиливает электроотрицательный атом азота, связанный с ним. На рисунках кажется, что водородная связь образуется между атомами кислорода и азота, так как в pdb-файлах не записана информация об атомах водорода и, соответственно, они не отображаются в Jmol. Часто таких связей образуется очень много, что существенно повышает их стабильность. Это особенно заметно при сравнении аномально высоких температур кипения и плавления воды с соответствующими температурами сходных веществ. В белках донором электронной плотности является атом кислорода, а акцептором - атом водорода. Всего в белке-регуляторе транскрипции 13 α-спиралей в составе цепи А и 12 - цепи В. Информация о них из PDB-файла представлена в таблице 1. Розовая строчка - α-спираль, у которой нет эквивалента в В-цепи. Голубым цветом отмечены α-спирали, изображенные на рисунке 1. Таблица 1. Информация из технической части файла 3S5R.pdb об альфа-спиралях. Розовым выделена непарная альфа-спираль, голубым - альфа-спирали, изображенные на рисунке 1
Структуры, соответствующие аминокислотным остаткам с 178 по 182 (ILE-PRO-THR-MSE-LYS) можно увидеть на рисунке 2. Водородные связи, присутствующие в обеих цепях, выделены черным. При чем в В-цепи они короче. Видно, что в А-цепи есть третья водородная связь, выделенная зеленым (ее длина 3,145 А). Расстояние между аналогичными атомами В-цепи (на рисунке соединены более тонкой зеленой линией) равно 3,380 А. Jmol не определяет здесь связь, однако существуют водородные связи длиннее этого значения (в том числе образующие 12 α-спираль). 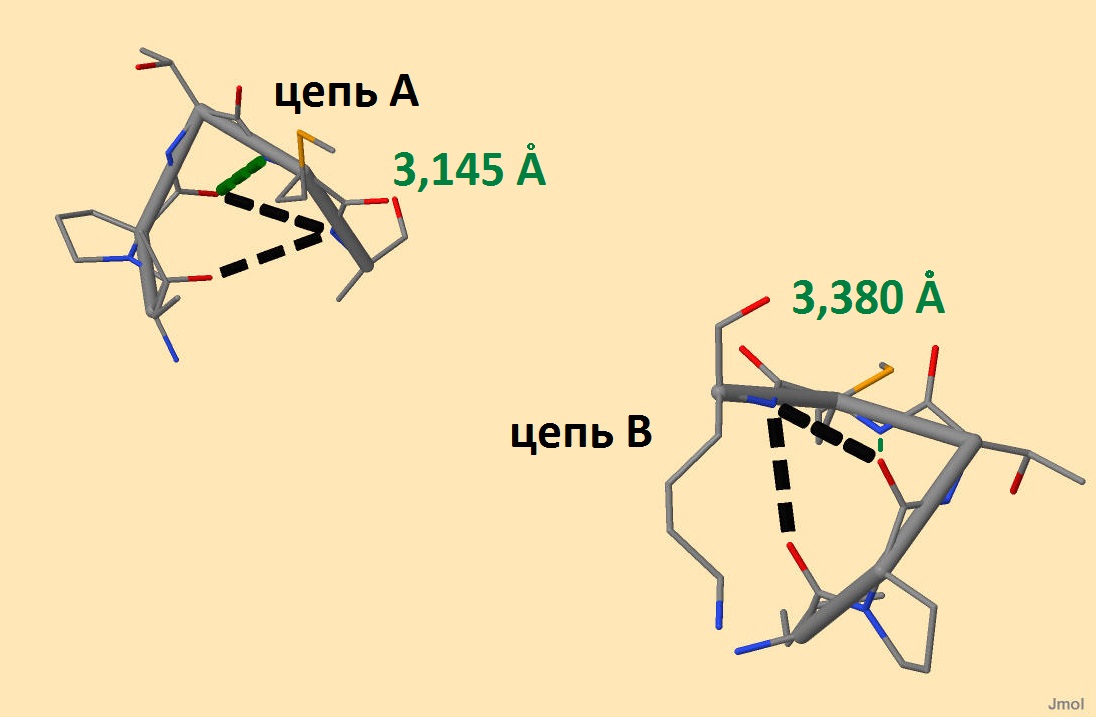
Рисунок 2. Аминокислотные остатки с 178 по 182 на обеих цепях. Черным и зеленым цветом выделены водородные связи (пунктирная линия). Комментарии в тексте В белке-регуляторе транскрипции нет β-складчатых листов, но для наглядности рассмотрим искусственно полученный полипептид, состоящий из 2 мономеров, стабилизированных дисульфидным мостиком и водородными связями (идентификатор в PDB - 1JY4). Мономер включает в себя β-складчатый лист из 4 антипараллельных цепей. В β-складчатых листах водородные связи располагаются перпендикулярно полипептидной цепи (в α-спиралях параллельно). Соединенные пептидные связи лежат в одной плоскости, поэтому соседние образуют складку, в вершине которой лежат С-α атомы. Углы φ и ψ приблизительно равны, но имеют противоположный знак. Образующаяся структура действительно похожа на складчатый лист. Радикалы соседних по цепи аминокислотных остатков направлены в противоположные стороны, что хорошо видно на рисунке 3. 
Рисунок 2. Структура восьми-цепочечного β-листа. Наглядна антипараллельность цепей 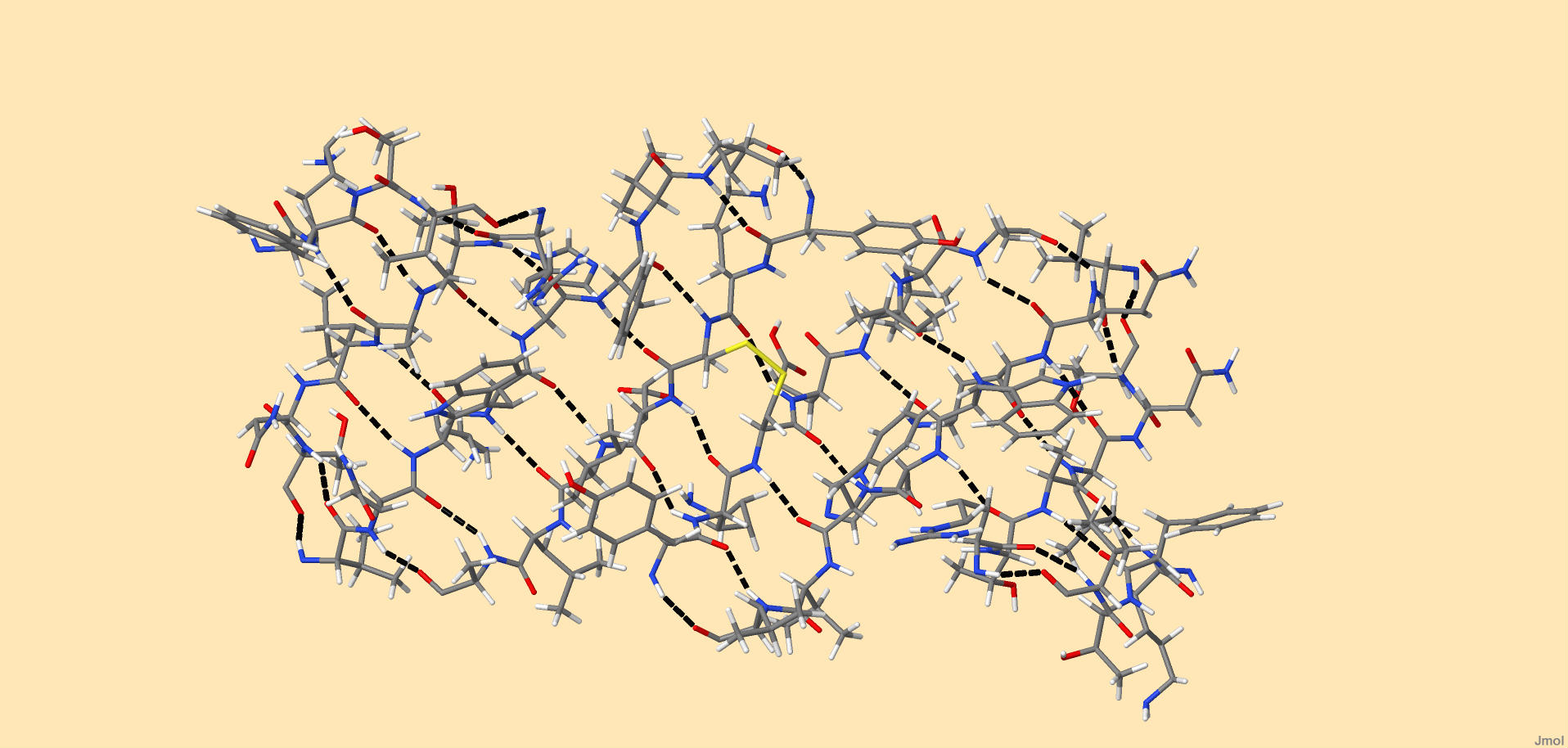
Рисунок 3. Основа структуры восьми-цепочечного β-листа. Водородные связи покрашены черным цветом 
Рисунок 4. Пространственное расположение восьми-цепочечного β-листа. Водородные связи покрашены черным цветом, направления β-листов изображены оранжевыми стрелочками β-структуры также стабилизированы водородными связями тех же атомов, что и α-спирали. В антипараллельных β-листах водородные связи практически образуют неравные циклы: из 14 и 10 атомов, что видно на рисунке 2. В параллельных - равные 12-членные циклы. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| © Pogorelskaya Sasha | Last modification date: 19.02.15 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||